ЭФИРЫ ПРОСТЫЕ, соед. общей ф-лы
R - О - R', где R и R' - углеводородный радикал. Различают симметричные
Э. п. (R и R' одинаковы) и смешанные, или несимметричные (R и R' различны).
К Э. п. относятся нек-рые виниловые эфиры, а также глимы, карбитолы,
целлозольвы, гетероциклич. соед. с атомом О в цикле, напр. оксиран,
оксолан, 1,4-диоксан, ТГФ и др.
Названия Э. п. производят от названий
углеводородных радикалов с добавлением слова "эфир" либо по заместит. номенклатуре,
используя название группы RO как приставку к названию углеводорода RH,
напр. C2H5OC2H5 наз. диэтиловый
эфир или этоксиэтан. Нек-рые Э. п. имеют тривиальные названия.
Э. п.- бесцв. жидкости (табл.) с характерным
запахом; они не образуют межмол. водородных связей, в отличие от спиртов
не ассоциированы и поэтому более летучи, чем спирты с тем же числом углеродных
атомов. Э. п. плохо раств. в воде, хорошо - в орг. р-рителях, растворяют
орг. соед., устойчивы к действию щелочей и щелочных металлов.
В ИК спектрах Э. п. наблюдается сильное
поглощение в области 1150-1085 см-1, характеристич. полосы в
видимой и УФ частях спектра отсутствуют, в спектрах ПМР хим. сдвиг 6 3,2-3,4
м. д. (для метоксиалканов) и 3,7 м. д. (для метоксиаренов).
Наличие в молекуле Э. п. атома кислорода
со своб. электронной парой определяет их основные св-ва. При действии сильных
протонных к-т образуются оксониевые соединения
[RR'OH]+Cl-
(за исключением полностью фторир. и ароматич. эфиров); с к-тами Льюиса
- относительно устойчивые эфираты, напр. эфираты трифторида бора RR'O х
BF3.
Иодистоводородная и бромистоводородная
к-ты расщепляют алифатич. и жирно-ароматич. Э. п. на алкилгалогенид и спирт
или фенол; р-ция протекает через промежуточные оксониевые соли по механизмам
SN1 или SN2. Расщепление метил-
и этилалкиловых эфиров посредством HI используют для количеств. определения
метокси- и этоксигрупп (метод Цейзеля). Метод основан на определении иода
в образовавшихся СН3I или C2H5I путем
пропускания последних в р-р AgNO3 (по кол-ву осажденного AgI)
либо окислением (по кол-ву выделившегося I2).
СВОЙСТВА НЕКОТОРЫХ ПРОСТЫХ ЭФИРОВ
|
Соединение
|
Мол. м.
|
Т.О,
|
Т. кип., °С
|
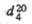 |
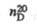 |
|
Диметиловый эфир
СН3ОСН3
|
46,07
|
——
|
-25
|
—
|
—
|
|
Диэталовый эфир
С2Н5ОС2Н5 |
74,12
|
—
|
34,5
|
0,7138
|
1,3526
|
|
Дипропиловый
эфир С3Н7ОСH7
|
102,2
|
-122
|
90,1
|
0,7360
|
1,3809
|
|
Диизопропиловый
эфир (СН3)2СНОСН(СН3)2
|
102,2
|
-86,2
|
68,5
|
0,7241
|
1,3679
|
|
Дибутиловый эфир
С4Н9ОС4Н9 |
130,2
|
-95,3
|
142
|
0,7704
|
1,3981
|
|
Диаллиловый эфир
(СН2=СНСН2)2О
|
98,2
|
—
|
94,0
|
0,8060
|
1,4163
|
|
Металфениловый
эфир (анизол) C6H5OCH3
|
108,13
|
-37,5
|
153,8
|
0,9954
|
1,5179
|
|
Эталфениловый
эфир (фенетол) C6H5OC2H5
|
122,2
|
-29,5
|
170
|
0,9651
|
1,5073
|
|
Дифениловый эфир
(днфенилоксид) С6Н5ОС6Н5
|
170,21
|
28-29
|
259,3
|
1,0748
|
1,5795
|
|
2-Метоксифенол
(гваякол) 2-СН3ОС6Н4ОН
|
124,13
|
28,5
|
205
|
1,1287а
|
1,5385а
|
|
1 ,2-Диметоксибензол
(вератрол) 1,2-(СН3О)2С6Н4
|
138,2
|
22,7
|
206,1
|
1,0801в
|
1,5320в
|
|
Эталеноксид (оксиран)
|
44,0
|
-112
|
11,0
|
0,8971в
|
1,3597г
|
а При 21,4 °С. 6 При 25 °С. вПри 0 оС. г При 7 °С.
При действии на Э. п. алкилнатрия или алкиллития
происходит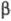 -элиминирование
с образованием алкена и алкоголята:
-элиминирование
с образованием алкена и алкоголята:
СН3СН2ОСН2СН3
+ RNa СН2
= СН2 + C2H5ONa + RH
СН2
= СН2 + C2H5ONa + RH
На воздухе или в присут. О2
при нормальной т-ре Э. п. склонны к автоокислению; образующиеся пероксиды
неустойчивы, легко взрываются и требуют осторожности при работе с ними.
Это св-во наиб. выражено у диизопропилового эфира.
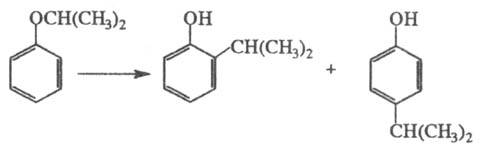
Под действием H2SO4,
A1C13, BF4 и т. п. эфиры фенолов изомеризуются в
орто-
и пара-алкилзамещенные фенолы (наиб. легко мигрирует третичный
радикал, труднее - первичный):
Аллилфениловые эфиры перегруппировываются
в орто- или пара-аллилфенолы (см. Клайзена перегруппировка).
Получают несимметричные Э. п. алкилированием
алкоголятов или фенолятов алкилгалогенидами (Вильямсона синтез). Для
получения симметричных Э. п. используют межмол. дегидратацию спиртов в
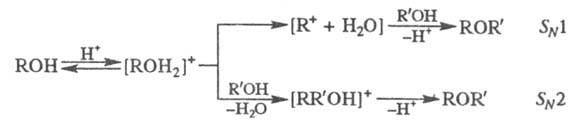
присут. конц. H2SO4. В зависимости от структуры спирта
р-ция может протекать по механизму SN1 или
SN2
Алкил- и арилметиловые эфиры получают взаимод. спиртов и фенолов с диазометаном в присут. к-т Льюиса (алкоголяты Al, BF3, A1C13 или HBF4), напр.:
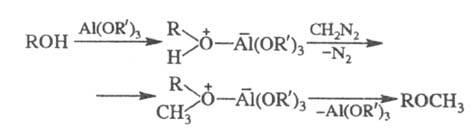
Э. п. образуются также при присоединении спиртов или фенолов к олефинам в присут. к-т (H2SO4, H3PO4, HC1, BF3):
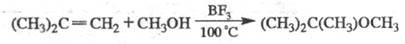
Э. п. - р-рители жиров, смол, красителей,
лаков и др. Ариловые эфиры - консерванты, антиоксиданты, применяются в
парфюм. пром-сти. Нек-рые Э. п. обладают инсектицидным действием.
См. также Анизол, Диизопропиловый эфир,
Диметиловый эфир, Дифенилоксид, Диэтиловый эфир, Фенетол.
Лит.: Гауптман 3., Грефе Ю., Ремане X., Органическая химия, пер. с нем., М., 1979, с. 332-40; Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 289-353; Kirk-Othmer encyclopedia, v. 9, N. Y., 1980, p. 381-92.
Л. Н. Максимова.



