ЭТИЛЕНОКСИД (оксиран, 1,2-эпоксиэтан,
окись этилена), мол. м. 44,05; бесцв. газ или жидкость с характерным эфирным
запахом; т. пл. -112,5 °С, т. кип. 10,7 °С;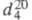 0,8697;
0,8697;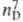 1,3597; длины связей 0,1462 нм (С —С), 0,1086 нм (С —Н), 0,1428 нм (С—О),
углы НСН 116,9°, СОС 61,62°; tкрит 195,8 °С, ркрит
7,19 МПа; Давление пара 145,8 кПа (20 °С);
1,3597; длины связей 0,1462 нм (С —С), 0,1086 нм (С —Н), 0,1428 нм (С—О),
углы НСН 116,9°, СОС 61,62°; tкрит 195,8 °С, ркрит
7,19 МПа; Давление пара 145,8 кПа (20 °С);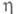 0,26
мПа х с (20 °С);
0,26
мПа х с (20 °С);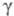 24,3 мН/м (20 °С);
24,3 мН/м (20 °С);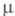 6,34 х 10-30Кл х м;
6,34 х 10-30Кл х м;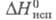 25,82 кДж/моль;
25,82 кДж/моль;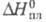 5,17 кДж/моль;
5,17 кДж/моль;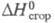 -1306
кДж/моль (газ); хорошо раств. в воде, этаноле, углеводородах и др. орг.
р-рителях.
-1306
кДж/моль (газ); хорошо раств. в воде, этаноле, углеводородах и др. орг.
р-рителях.

При нагр. до 300 °С Э. устойчив, св. 400
°С в смеси с N2 изомеризуется в ацетальдегид или образует этилен
(при избытке Э.); при окислении О2 в водном р-ре AgNO3
образуется гликолевая к-та, при окислении на оксидных и Ag-кат.- СО2
и
Н2О; при гидрировании над Ni-кат. при 30 °С - этанол.
Для Э. характерны р-ции, сопровождающиеся
размыканием цикла, что используют для оксиэтилирования (введение группы
СН2СН2ОН в орг. соед.). Большинство р-ций с нуклеоф.
реагентами протекают через промежут. образование оксониевого комплекса.
Гидратация Э. при 130-150 °С и давлении 1,5-2 МПа в присут. кислотных или
основных катализаторов приводит к этиленгликолю:
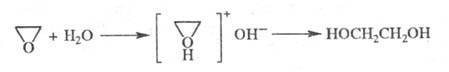
При взаимод. Э. с галогеноводородами в
водной среде образуются галогенгидрины; наиб. легко реагируют НВr и HI,
труднее - НС1; р-цию с HF проводят в среде диэтилового эфира (безводный
HF вызывает цепную полимеризацию Э.).
Со спиртами при нагревании Э. дает целлозолъвы,
а
при избытке Э.- карбитолы или эфиры полигликолей. С NH3
в присут. небольшого кол-ва воды образуется смесь моно-, ди-или триэтаноламинов;
р-ция диалкилэтаноламинов с Э. приводит к аминопроизводным полиэтиленгликолей:
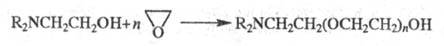
Э. легко реагирует с HCN в присут. щелочей, образуя этиленциангидрин, при дегидратации к-рого получают акрилонитрил.
С H2S в присут. воды при нагр.
Э. дает тиогликоль HSCH2CH2OH и тиодигликоль S(CH2CH2OH)2;
в присут. А12О3 при 200 °С - 1,4-дитиан или 1,4-оксатиан,
с тиолами образуются соответствующие орг. сульфиды.
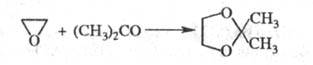
Р-ции Э. с орг. к-тами или их ангидридами
приводят к моно- и диэфирам этиленгликоля; с альдегидами и кетонами в присут.
SnCl2 или BF3 - к циклич. ацетатам или кеталям, напр.:
Э. вступает в р-цию Фриделя-Крафтса с ароматич.
углеводородами; эта р-ция лежит в основе синтеза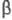 -фенилэтилового
спирта, последний образуется также при взаимод. Э. с фенилмагнийхлоридом.
-фенилэтилового
спирта, последний образуется также при взаимод. Э. с фенилмагнийхлоридом.
Р-ция Э. с СО2 в присут. четвертичных
солей аммония, фосфония и третичных аминов при 150-200 °С и давлении 2-8
МПа приводит к этиленкарбонату.
Э. легко полимеризуется, в зависимости
от природы инициатора можно получать полиэтиленоксид разл. мол.
массы. Известны также блоксополимеры Э., напр. с пропиленоксидом (см.
Проксанолы),
с
пропиленоксидом и этилендиамином (см. Проксамины).
При димеризации
Э. образуется 1,4-диоксан.
Осн. пром. метод синтеза Э.- окисление
этилена. Процесс осуществляют в трубчатых реакторах на неподвижном слое
катализатора (серебро с промотирующими или модифицирующими добавками, нанесенное
в кол-ве 10-15% по массе на пористый корундовый носитель) при 200-300 °С
и давлении 1-3 МПа, окислителями могут служить воздух или кислород.
Э. может быть получен также дегидрохлорированием
этиленхлоргидрина (этот метод ранее использовался в пром-сти), действием
щелочи на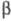 -хлорэтилацетат
С1СН2СН2ОСОСН3 при 100 °С либо на этилгипохлорит
С2Н5ОС1, окислением этилена орг. надкислотами (р-ция
Прилежаева).
-хлорэтилацетат
С1СН2СН2ОСОСН3 при 100 °С либо на этилгипохлорит
С2Н5ОС1, окислением этилена орг. надкислотами (р-ция
Прилежаева).
Э.- важный продукт основного орг. синтеза.
Его применяют в произ-ве этиленгликолей, галогенгидринов, этаноламинов,
диоксана, фенилэтанола, полиэтиленгликолей, неионогенных ПАВ, а также в
медицине для стерилизации мед. инструментов, одноразовых шприцов.
Э.- горюч, взрывоопасен и токсичен; КПВ
3-100% (по объему); т. всп. < -18 °С; при 22-кратном разбавлении становится
негорючим. Оказывает общеядовитое действие, раздражает кожу и слизистые
оболочки. ПДК в воздухе рабочей зоны 1 мг/м3.
Мировое произ-во ок. 9 млн. т в год (1989).
Лит.: Окись этилена, М, 1967; Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980, p. 432-71.
Б. Б. Чесноков.


