ЭТИЛЕН (этен) СН2 = СН2,
мол. м. 28,05; бесцв. газ со слабым запахом; т. пл. -169,15 °С, т. кип.
-103,71 °С;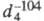 0,566; tкрит 9,2 °С, ркрит 5,042 МПа;
0,566; tкрит 9,2 °С, ркрит 5,042 МПа;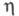 (жидкости) 0,161 мПа х с;
(жидкости) 0,161 мПа х с;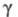 (жидкости) 16,4 мН/м; давление пара (кПа): 4110 (0 °С), 2200 (-25 °С),
151 (-100 °С); Ср 62,16 Дж/(моль х К) (-193 °С);
(жидкости) 16,4 мН/м; давление пара (кПа): 4110 (0 °С), 2200 (-25 °С),
151 (-100 °С); Ср 62,16 Дж/(моль х К) (-193 °С);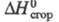 -1400 кДж/моль. Р-римость (мл в 100 мл р-рителя при О °С): вода 25,6, этанол
359; хорошо раств. в диэтиловом эфире и углеводородах.
-1400 кДж/моль. Р-римость (мл в 100 мл р-рителя при О °С): вода 25,6, этанол
359; хорошо раств. в диэтиловом эфире и углеводородах.
В природе Э. практически не встречается.
В незначит. кол-вах образуется в тканях растений и животных как промежут.
продукт обмена в-в. Он обладает св-вами фитогормонов -
замедляет
рост, ускоряет старение клеток, созревание и опадение плодов.
По хим. св-вам - типичный представитель
олефинов,
обладает высокой реакционной способностью, особенно в р-циях электроф.
присоединения. При взаимод. Э. с хлором образуется дихлорэтан, к-рый при
дегидрохлорировании превращается в винилхлорид; последний м. б. получен
в одну стадию в присут. силицида кремния при 450-550 °С. Гидратация Э.
приводит к этиловому спирту, гидрогалогенирование - к этилхлориду, взаимод.
с SC12 или S2C12 - к иприту S(CH2CH2C1)2,
окисление кислородом или воздухом в присут. оксида Ag при 200-300 °С -
к этиленоксиду; жидкофазное окисление кислородом в водных р-рах PdCl2
и СиС12 при 130 °С и 0,3 МПа - к ацетальдегиду; в тех же условиях
в присут. СН3СООН образуется винилацетат.
Э.- алкилирующий агент, широко используется
для алкилирования бензола; р-цию проводят в газовой фазе при 400-450 °С
и давлении 1,4 МПа в присут. А1С13 в стационарном слое кизельгура,
пропитанного Н3РО4 (возможно использование BF3
и цеолитов).
Э.- исходное соед. для получения
полиэтилена
высокого
и низкого давления и олигомеров этилена, являющихся основой ряда синтетич.
смазочных масел. Сополимеризацией Э. с пропиленом на катализаторах Циглера-Натты
получают этилен-пропиленовые каучуки,
обладающие повышенной устойчивостью
к окислению и истиранию. В пром-сти получают также сополимеры Э. со стиролом
и винилацетатом.
Осн. метод получения Э.- пиролиз жидких
дистиллятов нефти или низших парафиновых углеводородов. Р-цию обычно проводят
в трубчатых печах при 750-900 °С и давлении 0,3 МПа. В России, Западной
Европе и Японии сырьем служит прямогонный бензин; выход Э. ок. 30% с одновременным
образованием значит. кол-ва жидких продуктов, в том числе ароматич. углеводородов.
При пиролизе газойля выход Э. 15-25%. В США осн. сырье - легкие алканы
(этан, пропан, бутан), что обусловлено их высоким содержанием в прир. газе
месторождений Северной Америки; выход Э. ок. 50%.
Разработан метод получения Э. из метана:
2СН4 С2Н4 + Н2; р-цию проводят на оксидах Mn,
Tl, Cd или Рb при 500-900 °С в присут. кислорода. Газы пиролиза разделяют
дробной абсорбцией, глубоким охлаждением и ректификацией под давлением.
Наиб. чистый Э. получают дегидратацией этанола при 400-450 °С над А12О3;
этот метод пригоден для лаб. получения Э.
С2Н4 + Н2; р-цию проводят на оксидах Mn,
Tl, Cd или Рb при 500-900 °С в присут. кислорода. Газы пиролиза разделяют
дробной абсорбцией, глубоким охлаждением и ректификацией под давлением.
Наиб. чистый Э. получают дегидратацией этанола при 400-450 °С над А12О3;
этот метод пригоден для лаб. получения Э.
Применяют Э. в пром. орг. синтезе (в ряде
процессов он вытесняет ацетилен), а также как регулятор роста растений,
для ускорения созревания плодов, дефолиации растений и снижения преждевременного
опадания плодов.
Э. взрывоопасен, КПВ 3-34% (по объему),
т. всп. 136,1 °С, т. самовоспл. 540 °С, ПДК в атм. воздухе 3 мг/м3,
в воздухе рабочей зоны 100 мг/м3.
Мировое произ-во 50 млн. т в год (1988).
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980, p. 393-431.
А. А. Братков.


