ЭТАН
СН3СН3, мол. м. 30,07; газ без цвета и запаха; т.пл.
-183,23 °С, т. кип. -88,63 °С;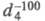 0,572; tкрит 32,3 °С, pкрит 4,87 МПа, dкрит0,2045
г/см3; давление пара 2,379 МПа (0°С); Ср 12,58 Дж/(моль*К)
(25 °С);
0,572; tкрит 32,3 °С, pкрит 4,87 МПа, dкрит0,2045
г/см3; давление пара 2,379 МПа (0°С); Ср 12,58 Дж/(моль*К)
(25 °С);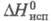 14,68 кДж/моль;
14,68 кДж/моль;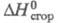 -1541,4 кДж/моль;
-1541,4 кДж/моль;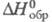 -106,7
кДж/моль. Р-римость (мл в 100 мл р-рителя): вода 4,7 при 20 °С, этанол 46 при
0 °С, хорошо раств. в углеводородах.
-106,7
кДж/моль. Р-римость (мл в 100 мл р-рителя): вода 4,7 при 20 °С, этанол 46 при
0 °С, хорошо раств. в углеводородах.
По хим. св-вам Э.- типичный представитель
насыщенных
углеводородов. Вступает в разл. р-ции замещения по радикальному механизму.
Термич. дегидрирование Э. при 550-650 °С приводит к этилену, при т-рах
свыше 800 °С - к ацетилену (образуется также бензол и сажа), прямое хлорирование
при 300-450 °С - к этилхлориду, окисление - к смеси СН3СНО и
СН3СООН, нитрование в газовой фазе дает смесь (3:1) нитроэтана
и нитрометана.
Э.- компонент прир. и попутных газов (до
10% по объему) и м. б. выделен из них низкотемпературной ректификацией.
Значит, кол-ва Э. образуются при крекинге нефтяного сырья. В лаб. условиях
Э. получают из СН3I по р-ции Вюрца, из CH3COONa электролизом
по р-ции Кольбе, сплавлением пропионата Na с щелочью, из этилбромида по
р-ции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присут.
Ni-Ренея).
Э- сырье для получения этилена и винилхлорида.
В США и Канаде 60% этилена получают из этана, в России и Западной Европе
этот способ нерентабелен из-за низкого содержания Э. в прир. газе местных
месторождений.
В смеси с воздухом Э. взрывоопасен. Т.
всп. 152 °С, т. самовоспл. 472 °С, КПВ 2,9-15,0 % . Нетоксичен.
А. А. Братков.


