ЭЛЕКТРОХИМИЯ РАСПЛАВОВ,
изучает
физ.-хим. процессы в расплавл. электролитах. Электролитами служат соли,
их смеси и р-ры ионизируемых в этих расплавах в-в, напр. оксидов. Т-ры
плавления используемых электролитов обычно лежат в пределах 400-900 °С.
Смеси солей применяют для снижения т-ры плавления. Обычно это расплавленные
смеси галогенидов щелочных и щел.-зем. металлов (NaCl, KC1, СаС12,
ВаС12 и др.), эквивалентная электрич. проводимость к-рых составляет
50-150 См * см2. Высокая электрич. проводимость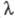 расплавленных солей указывает на ионную природу расплава и служит мерой
степени ионизации солей.
расплавленных солей указывает на ионную природу расплава и служит мерой
степени ионизации солей.
Особенность расплавленных электролитов,
помимо высокой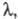 -
большое напряжение разложения, часто превышающее 3 В. Это позволяет при
электролизе выделять из расплавленных электролитов гораздо больший круг
металлов, чем из водных р-ров (напряжение разложения воды при комнатной
т-ре 1,23 В) и создавать хим. источники тока с эдс до 2,5-3,5 В.
-
большое напряжение разложения, часто превышающее 3 В. Это позволяет при
электролизе выделять из расплавленных электролитов гораздо больший круг
металлов, чем из водных р-ров (напряжение разложения воды при комнатной
т-ре 1,23 В) и создавать хим. источники тока с эдс до 2,5-3,5 В.
Процессы на электродах в расплавах электролитов
протекают при потенциалах, близких к равновесным по отношению к приэлектродным
слоям расплавов. Зависимость потенциала разложения расплава от т-ры имеет
линейный характер с отрицат. наклоном.
Как и в водных р-рах, для металлов в расплавах
существуют электрохим. ряды напряжений, индивидуальные для каждого расплавленного
электролита. Электродные потенциалы металлов в расплавленных солях подчиняются
Нернста
уравнению. Разность потенциалов нулевого заряда металлов в расплавленных
солях близка к контактной разности потенциалов (возникает между пов-стями
двух металлов в вакууме при их соприкосновении) в соответствии с теорией
гальванич. потенциалов Фрумкина.
Для расплавов, как и для водных р-ров
электролитов, характерно образование комплексных соединений. Прочность
комплексов увеличивается с увеличением заряда центрального атома, электрохим.
потенциала лиганда и радиуса катиона щелочного металла в электролите-растворителе.
Для расплавов характерно сосуществование неск. валентных форм ионов, равновесных
с металлом. Поэтому средняя валентность ионов металла иногда выражается
нецелым числом.
Особенность кинетики электродных процессов
в расплавленных солях - высокие скорости электрохим. р-ций. Поэтому их
можно считать квазиравновесными процессами. наиб. медленной (лимитирующей)
стадией электродного процесса обычно является массоперенос в-ва к электроду
(диффузия или миграция). Исключением являются стадии зарождения кристаллов
при электрокристаллизации и образование молекул газа из адсорбированных
на электроде атомов, к-рые протекают еще медленнее (или с соизмеримыми
скоростями). Напр., разряд А1 в расплавленных хлоралюминатах, как показано
с помощью импедансных измерений, происходит в условиях одновременного замедленного
протекания разряда, кристаллизации и диффузии.
Высокая т-ра ускоряет в значит. степени
диффузию в твердой фазе, что обусловливает образование диффузионных сплавов
при осаждении металла на твердом электроде.
Полярографич. методы позволяют определить
в ионных расплавах для многих электродных процессов коэф. диффузии, энергию
активации, толщину диффузионного слоя, коэф. переноса, константы скорости
р-ций, токи обмена.
Электролизом расплавленных солей получают
А1, а также Mg, щелочные металлы, Са, Zr, Th и др., рафинируют Ti, металлы
платиновой группы. Разработаны методы получения покрытий из металлов, сплавов
и интерметаллидов электроосаждением и бестоковым методом - переносом через
солевой расплав благодаря энергии, выделяющейся при образовании сплавов,
контактным восстановлением и диспропорцио-нированием, стимулированным комплексообразованием.
Покрытия, полученные из расплавленных
солей, обладают высокой чистотой, пластичностью, хорошим сцеплением с основой,
исключают наводороживание покрываемого изделия, что обеспечивает более
высокие технол. качества, чем при получении покрытий из водных р-ров. Гальванопластикой
из расплавленных солей получают фасонные полые изделия из тугоплавких металлов
(Ni, Mo, Re) и металлов платиновой группы (Ir, Ru).
На основе расплавленных солей созданы
высокотемпературные хим. источники тока, обладающие высокими эдс и большими
разрядными токами. Высокотемпературные топливные элементы с расплавленным
карбонатным электролитом преобразуют при 650-700 °С хим. энергию газообразного
топлива (водород, природный газ) в электроэнергию с кпд прямого преобразования
до 60%. Перспективно их использование в стационарной энергетике.
Лит.: Укше Е. А., Букун Н. Г., в кн.: Итоги науки и техники. Растворы. Расплавы, т. 2, М., 1975, с. 140-71; Барабошкин А. Н., Электрокристаллизация металлов из расплавленных солей, М„ 1976; Электрохимия расплавленных солей и металлов, под ред. К. П. Селезнева, Л., 1976; Делимарский Ю. К., Электрохимия ионных расплавов, М., 1978.
Г. В. Жутаева.


