ЭЛЕКТРОННАЯ ПЛОТНОСТЬ, плотность
вероятности распределения электронов в квантовой системе (атоме, молекуле,
кристалле). В квантовой химии в понятие Э. п. вкладывают неск. смыслов.
Если система N электронов описывается волновой ф-цией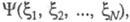 где символом
где символом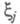 обозначен набор всех координат электрона, включая спиновую координату
обозначен набор всех координат электрона, включая спиновую координату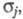 то обычно задают Э. п. как ф-цию радиус-вектора электрона r (r = r1)
то обычно задают Э. п. как ф-цию радиус-вектора электрона r (r = r1)
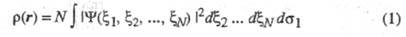
(интегрирование ведется по всей области
изменения указанных переменных). Поскольку согласно Паули принципу ф-ция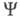 антисимметрична относительно перестановок электронных переменных,
антисимметрична относительно перестановок электронных переменных,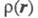 не зависит от того, координаты какого именно электрона фигурируют в ее
определении. Э. п.
не зависит от того, координаты какого именно электрона фигурируют в ее
определении. Э. п.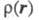 отражает пространственное распределение заряда и электрич. св-ва частицы
(дипольный момент и т. п.), ее наз. также зарядовой плотностью.
отражает пространственное распределение заряда и электрич. св-ва частицы
(дипольный момент и т. п.), ее наз. также зарядовой плотностью.
Если в выражении (1) при интегрировании
по спиновой переменной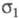 учитывать, что проекции спина на выделенную ось различны, то
учитывать, что проекции спина на выделенную ось различны, то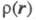 определяется как спиновая плотность и отражает пространственное распределение
спина в мол. системах с ненулевым суммарным спином (радикалы, триплетные
возбужденные состояния молекул и др.). Спиновая плотность м. б. изучена
экспериментально методами ЭПР.
определяется как спиновая плотность и отражает пространственное распределение
спина в мол. системах с ненулевым суммарным спином (радикалы, триплетные
возбужденные состояния молекул и др.). Спиновая плотность м. б. изучена
экспериментально методами ЭПР.
В экспериментах по рассеянию электронов
или по ионизации молекул электронным ударом данные об энергетич. распределении
электронов позволяют оценить импульсную Э. п., к-рая определяется ф-лой
(1), при условии, что координатное представление ф-ции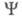 заменено
на импульсное, т. е. в роли
заменено
на импульсное, т. е. в роли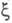 использованы вектор импульса электрона Р и спин. Величина р(Р) позволяет
находить кинетич. энергию и импульсы электронов системы.
использованы вектор импульса электрона Р и спин. Величина р(Р) позволяет
находить кинетич. энергию и импульсы электронов системы.
Э. п.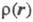 чаще
всего получают с помощью рентгенографич. экспериментов - т. наз. форм-факторы
отвечают фурье-обра-зу
чаще
всего получают с помощью рентгенографич. экспериментов - т. наз. форм-факторы
отвечают фурье-обра-зу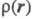 (см.
Рентгеновский
структурный анализ). Зависимость Э. п. от положений ядер усреднена
при этом по термодина-мич. ансамблю, т. е. определяется с поправкой на
тепловое движение. Оценки
(см.
Рентгеновский
структурный анализ). Зависимость Э. п. от положений ядер усреднена
при этом по термодина-мич. ансамблю, т. е. определяется с поправкой на
тепловое движение. Оценки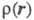 представляют картами типа топографических, на к-рых для определенных сечений
трехмерного пространства задаются линии уровня Э. п.
представляют картами типа топографических, на к-рых для определенных сечений
трехмерного пространства задаются линии уровня Э. п.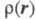 =
const. Как правило, Э. п. имеет максимумы лишь в точках Ra,
отвечающих
положениям ядер, и хотя в целом Э. п.- гладкая ф-ция, в указанных точках
она имеет особенности: вдоль любого направления, выходящего из точки Ra,
модуль градиента Э. п. не равен нулю и пропорционален заряду ядра Za
(т. наз. условие Като). Нек-рые из ядер на картах Э. п. соединены "хребтами",
к-рые можно соотнести с хим. связями. Такое соотнесение естественно, поскольку
топология электронных распределений существенно меняется лишь при таких
изменениях ядерной конфигурации, к-рые можно связать с изменением системы
связей. Приводят и разностные карты Э. п. молекул и образующих их атомов,
позволяющие судить об особенностях перераспределения Э. п. при образовании
молекул или кристаллов из атомов.
=
const. Как правило, Э. п. имеет максимумы лишь в точках Ra,
отвечающих
положениям ядер, и хотя в целом Э. п.- гладкая ф-ция, в указанных точках
она имеет особенности: вдоль любого направления, выходящего из точки Ra,
модуль градиента Э. п. не равен нулю и пропорционален заряду ядра Za
(т. наз. условие Като). Нек-рые из ядер на картах Э. п. соединены "хребтами",
к-рые можно соотнести с хим. связями. Такое соотнесение естественно, поскольку
топология электронных распределений существенно меняется лишь при таких
изменениях ядерной конфигурации, к-рые можно связать с изменением системы
связей. Приводят и разностные карты Э. п. молекул и образующих их атомов,
позволяющие судить об особенностях перераспределения Э. п. при образовании
молекул или кристаллов из атомов.
С Э. п. обычно связывают эффективные заряды
на атомах. Так, если с атомом соотнести нек-рую пространств. область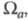 ,
то эффективный заряд Qa можно определить как
,
то эффективный заряд Qa можно определить как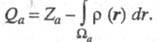 Область
Область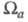 и заряд
Qa
зависят от геометрии молекулы (и способа выделения
и заряд
Qa
зависят от геометрии молекулы (и способа выделения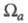 причем атому, вообще говоря, может отвечать неограниченная область пространства).
В экспериментах по ЯМР, ЯКР и мёссбауэровской спектроскопии изменение Э.
п. вблизи ядра нередко интерпретируют с помощью зарядов на атомах. Распределение
электронов в области внутр. оболочек атома меняется под действием соседних
ядер, что определяется по данным фото- и рентгеноэлектронной спектроскопии.
Эти явления также описывают как изменение зарядов на атомах. Все указанные
заряды определяются поведением Э. п. в разл. областях пространства и, вообще
говоря, не коррелируют друг с другом или с дипольным моментом мол. системы.
причем атому, вообще говоря, может отвечать неограниченная область пространства).
В экспериментах по ЯМР, ЯКР и мёссбауэровской спектроскопии изменение Э.
п. вблизи ядра нередко интерпретируют с помощью зарядов на атомах. Распределение
электронов в области внутр. оболочек атома меняется под действием соседних
ядер, что определяется по данным фото- и рентгеноэлектронной спектроскопии.
Эти явления также описывают как изменение зарядов на атомах. Все указанные
заряды определяются поведением Э. п. в разл. областях пространства и, вообще
говоря, не коррелируют друг с другом или с дипольным моментом мол. системы.
Э. п. может быть точно представлена с
помощью т. наз. натуральных орбиталей Фj j=1,
2, ... в форме выражения
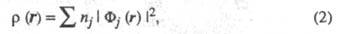
где заселенности пj -
неотрицат. числа, не превосходящие 2, причем сумма всех заселенностей (при
бесконечном, вообще говоря, числе значений j)равна N. В
приближении мол. орбиталей все занятые орбитали системы можно считать натуральными.
Переход к локализованным орбиталям позволяет описать Э. п. вблизи ядра
неск. орбиталями, соотносимыми с хим. связью, или неподеленной парой электронов.
При моделировании натуральных орбиталей нередко используют гибридные орбитали
(см. Гибридизация атомных орбиталей). В рамках ЛКАО-приближения
Э.
п. определяют через коэф. разложения в ряд натуральных мол. орбиталей по
атомным орбиталям, причем пространств. область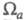 соотносится с областью локализации атомной орбитали. Симметрия мол. орбиталей
позволяет разбить Э. п. на вклады, создаваемые
соотносится с областью локализации атомной орбитали. Симметрия мол. орбиталей
позволяет разбить Э. п. на вклады, создаваемые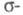 и
и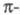 электронами,
и анализировать их раздельно, учитывая при необходимости их взаимное влияние
(напр., индукционное) (см.
электронами,
и анализировать их раздельно, учитывая при необходимости их взаимное влияние
(напр., индукционное) (см.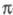 -Электронное
приближение).
-Электронное
приближение).
Согласно теореме Хоенберга-Кона, для основного
состояния молекулы Э. п. отражает всю специфику молекулы. Напр., при r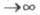 Э. п. экспоненциально спадает, причем показатель экспоненты пропорционален
потенциалу
ионизации. Делаются попытки соотнести энергию молекулы с величиной
Э. п. экспоненциально спадает, причем показатель экспоненты пропорционален
потенциалу
ионизации. Делаются попытки соотнести энергию молекулы с величиной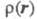 в рамках к.-л. из вариационных методов (т. наз. методы функционалов плотности),
одним из первых вариантов к-рых можно считать приближение Томаса-Ферми;
иногда к этим методам относят самосогласованного поля метод.
в рамках к.-л. из вариационных методов (т. наз. методы функционалов плотности),
одним из первых вариантов к-рых можно считать приближение Томаса-Ферми;
иногда к этим методам относят самосогласованного поля метод.
Э. п.- важная физ. характеристика мол.
системы, анализ к-рой позволяет соотнести хим. строение молекулы с локальными
особенностями электронного распределения. Перераспределение Э. п. молекулы
по сравнению с Э. п. входящих в ее состав атомов отражает характер хим.
связи и позволяет судить о взаимном влиянии атомов, изменении строения
того или иного мол. фрагмента в ряду родственных молекул. Методы изучения
и анализа Э. п. интенсивно развиваются.
Лит. см. при ст. Квантовая химия.
В. И. Пупышев.


