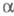 -Agl
на 42 позиции приходятся 2 иона Ag+, причем 12 тетраэдрич. позиций
являются предпочтительными. Т. обр., подрешетка ионов проводимости разупорядочена,
в то время как остальные ионы Э. т. образуют жесткий каркас, и их перенос
возможен по обычным механизмом образования точечных дефектов (вакансий
и междоузельных ионов).
-Agl
на 42 позиции приходятся 2 иона Ag+, причем 12 тетраэдрич. позиций
являются предпочтительными. Т. обр., подрешетка ионов проводимости разупорядочена,
в то время как остальные ионы Э. т. образуют жесткий каркас, и их перенос
возможен по обычным механизмом образования точечных дефектов (вакансий
и междоузельных ионов).
Ионная составляющая
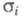 общей проводимости Э. т., как правило, на 5-6 порядков больше электронной,
т. е. числа переноса (см. Электропроводность электролитов)ионов
проводимости практически равны 1. Коэф. диффузии Di этих
ионов сравнимы с таковыми для конц. водных р-ров и соответствуют величинам
порядка 10-5 - 10-6 см2/с.
общей проводимости Э. т., как правило, на 5-6 порядков больше электронной,
т. е. числа переноса (см. Электропроводность электролитов)ионов
проводимости практически равны 1. Коэф. диффузии Di этих
ионов сравнимы с таковыми для конц. водных р-ров и соответствуют величинам
порядка 10-5 - 10-6 см2/с.
Э. т. относят к суперионным проводникам и часто наз. супериониками. Однако суперионик- более общее понятие, относящееся к высокопроводящим соед. как с ионной проводимостью (Э. т.), так и со смешанной ионно-электронной проводимостью. В электрохим. системах в отличие от Э. т. суперионики со смешанной проводимостью выполняют роль электродов.
Температурная зависимость ионной проводимости Э. т.
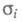 описывается
ур-нием:
описывается
ур-нием:
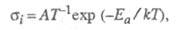
где А - константа, Т -
абс. т-ра,
Еа - энергия активации, k -константа Больцмана.
Значение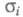 и Еа
для наиб. известных Э. т. приведены в таблице.
и Еа
для наиб. известных Э. т. приведены в таблице.
Э. т. подразделяются на электролиты с
собственным структурным разупорядочением в одной из подрешеток и с примесным.
К первым относятся в-ва, структура к-рых либо уже имеет пути проводимости
для ионов определенного типа, как, напр., Na-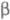 -глинозем
(полиалюминат натрия Na1+xAl11O17),
либо приобретает их вследствие фазового перехода, как, напр., Agl (
-глинозем
(полиалюминат натрия Na1+xAl11O17),
либо приобретает их вследствие фазового перехода, как, напр., Agl ( -переход при 420 К). Пути проводимости могут иметь вид каналов [напр.,
в (C5H5NH)Ag5I6], щелей (напр.,
в Na-
-переход при 420 К). Пути проводимости могут иметь вид каналов [напр.,
в (C5H5NH)Ag5I6], щелей (напр.,
в Na- -глиноземе)
или трехмерных сеток (напр., в
-глиноземе)
или трехмерных сеток (напр., в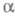 -Agl).
-Agl).
К Э. т. с примесным разупорядочением относятся
твердые р-ры замещения, образующиеся в ионных кристаллах при легировании
их ионами с валентностью, отличной от валентности основного иона. Возникающий
при этом дефицит (или избыток) заряда компенсируется образованием дефектов
противоположного знака. Так, в оксидах Zr, Hf, Се и Th, легир. оксидами
двух- и трехвалентных металлов (Са, Y, Sc и др.), компенсация заряда примеси
осуществляется кислородными вакансиями. Флюорит CaF2 и изоморфный
ему SrF2 образуют твердые р-ры замещения с фторидами трехвалентных
РЗЭ, обладающих высокой подвижностью ионов F-. Последние легко
обмениваются на ионы О2-.
Характерное св-во Э. т.- способность к
замещению одних ионов проводимости на другие. Напр., при выдерживании Na-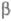 -глинозема
в расплаве AgNO3 ионы Na+ м. б. полностью замещены
ионами Ag+. Если же Ag-b-глинозем
поместить в р-р к-ты, то можно получить
-глинозема
в расплаве AgNO3 ионы Na+ м. б. полностью замещены
ионами Ag+. Если же Ag-b-глинозем
поместить в р-р к-ты, то можно получить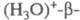 глинозем с высокой проводимостью по протонам - ионам Н+.
глинозем с высокой проводимостью по протонам - ионам Н+.
ХАРАКТЕРИСТИКА ПОЛИКРИСТАЛИЧЕСКИХ ТВЕРДЫХ
ЭЛЕКТРОЛИТОВ
|
Электролит
|
Подвижный ион
|
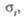
См/м (298 K) |
Ea,
эВ |
 |
Ag+
|
337 (423 K)
|
0,101a
|
|
RbAg4I5
|
Ag+
|
28
|
0,104
|
|
Ag6WO4I4
|
Ag+
|
4,2
|
0,248
|
|
(C5H5NH)Ag5I6
|
Ag+
|
21 (323 K)
|
0,198б
|
|
Cs2Ag3Br3I2
|
Ag+
|
0,1
|
0,38
|
|
Cu4RbCl3I2
|
Cu+
|
47
|
0,115
|
|
Na2O
x 10Al2O3e
|
Na+
|
3,3
|
0,140
|
|
Na2O
x 10Al2O3
|
Na+
|
0,5
|
0,148
|
|
Na3Zr2Si2Р012
|
Na+
|
14 (573 K)
|
0,246д
|
|
Nа3Sс2(РO4)3
|
Na+
|
19 (573 K)
|
0,144в
|
|
Na5DySi4O12
|
Na+
|
0,50
|
0,208
|
|
CsHSO4
|
H+
|
1,8 (435 K)
|
0,33ж
|
|
HUO2PO2
x
4H2O3
|
H+
|
0,32
|
0,32
|
|
H3PW12O40
x 19H2O3
|
H+
|
1,20
|
0,432
|
|
Cs3PW12O40
x
10H2O3
|
H+
|
1,6
|
0,223
|
|
Sb2O5
x
5,43H2O3
|
H+
|
0,75
|
0,16
|
|
0,75Li4GeO4
x 0,25Li3PO4
|
Li+
|
9,1 (573 K)
|
0,42
|
|
Sr0,8La0,2F2,2
|
F-
|
0,11 (573 K)
|
0,196
|
|
0,91ZrO2
x
0,09Sc2O3
|
O2-
|
30 (1273 K)
|
0,43
|
|
(Bi2O3)0,8(SrO)0,2
|
O2-
|
0,6 (773 K)
|
0,8
|
aПри Т>420 К. бПри Т>315 К. вСтеклообразное состояние. гМонокристалл (перпендикулярно оси с). дПри Т>505 К. вПри Т>429 К. жПри Т>414 К. зДанные при относит. влажности ок. 60%
Протонпроводящие Э. т.- в осн. кристаллогидраты
твердых орг. и неорг. к-т и их солей, в к-рых перенос Н осуществляется
либо по сетке водородных связей молекул Н2О (механизм туннельного
перехода), либо перемещением иона гидроксония Н3О+
(прыжковый механизм), либо по молекулам, адсорбир. на межзеренных границах
поликристаллич. материала. Исключение составляют безводные гидросульфаты
и гидроселенаты щелочных металлов (напр., CsHSO4 и CsHSeO4),
к-рые приобретают высокую ионную проводимость при т-рах выше структурного
фазового перехода, когда число возможных мест локализации протонов оказывается
вдвое больше числа самих протонов. Обладают протонной проводимостью и мн.
полимерные структуры (см. ниже).
Большинство Ag+-проводящих
Э. т. получают либо выращиванием монокристаллов (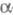 -Agl,
RbAg4I5), либо твердофазным синтезом (RbAg4I5,
(C5H5NH)Ag5I6 и др.). Для изготовления
Li+-, Na+- и О2- -проводящих Э. т. используют
технологию произ-ва керамики.
-Agl,
RbAg4I5), либо твердофазным синтезом (RbAg4I5,
(C5H5NH)Ag5I6 и др.). Для изготовления
Li+-, Na+- и О2- -проводящих Э. т. используют
технологию произ-ва керамики.
Существуют полимерные Э. т., к-рые обладают
пластичностью, из них можно изготавливать тонкие пленки толщиной 0,5-250
мкм. По электропроводности они сравнимы с жидкими и твердыми электролитами
(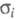 1-10-3
См/м). Полимерные Э. т.- как правило, аморфные комплексы полимер-соль или
полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по
строению полимеров. Ион проводимости определяется природой второго компонента.
При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям
полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет
ур-нию, основанному на теории свободного объема:
1-10-3
См/м). Полимерные Э. т.- как правило, аморфные комплексы полимер-соль или
полимер-к-та на. Получают их из полиэтиленоксида (ПЭО) и др. сходных по
строению полимеров. Ион проводимости определяется природой второго компонента.
При этом ион мигрирует вдоль полимерной цепи благодаря сегментальным движениям
полимерной матрицы. Температурная зависимость проводимости комплексов удовлетворяет
ур-нию, основанному на теории свободного объема:
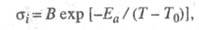
где Т0 - идеальная т-ра
стеклования полимера, Т - т-ра системы, В -
константа.
В системе ПЭО-Н3РО4
образуется комплекс (ПЭО) Н3РО4 с n =1,33,
обладающий протонной проводимостью ок. 10-3 См/м (298 К). В
комплексе ПЭО-NH4НSО4 анионы практически неподвижны
и протон переносится катионами (
(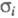 2 x 10-2
См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+,
так и
2 x 10-2
См/м). В комплексах ПЭО-LiС1О4 ток переносится как ионами Li+,
так и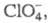 на подвижность
к-рых оказывает влияние неполная диссоциация соли и образование ионных
кластеров
на подвижность
к-рых оказывает влияние неполная диссоциация соли и образование ионных
кластеров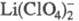 и
и
Аморфные структуры со св-вами Э. т. существуют
и среди неорг. соединений. Это - стекла, представляющие собой трехмерные
сетки, не имеющие строгой периодичности, но сохраняющие ближний порядок
в расположении ионов. Такие структуры типа -RbAg4I5
обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X =
С1, Вr, I).
-RbAg4I5
обнаружены в смешанных галогенидных системах AgX-CsX и AgX-CuX-CsX (X =
С1, Вr, I).
Используют Э. т. в химических источниках
тока, ионисторах, хим. сенсорах, в качестве ионселективных мембран, при
термодинамич. исследованиях и др.
Лит.: Укше Е. А., Букун Н.Г., Твердые электролиты, М., 1977; Чеботин В.Н., Перфильев М. В., Электрохимия твердых электролитов, М., 1978; Атовмян Л. О., Укше Е. А., в сб.: Физическая химия. Современные проблемы, под ред. Я. М. Колотыркина, М., 1983; Гуревич Ю. Я., Твердые электролиты, М., 1986; Мурыгин И. В., Электродные процессы в твердых электролитах, М., 1991; Сыромятников В. Г. [и др.], "Успехи химии", 1995, т. 64, в. 3, с. 265-74; Solid electrolytes, ed. by S. Geller., В., 1977; Armand M. В., Chabagno J. M., Duclot M. J., в кн.: Fast lon transport in solids, ed. P. Vashisnta, Amst., 1979, p. 131; Poulsen F. W., в кн.: High conductivity solid ionic conductors. Recent trends and applications, ed. by T. Takahashi, L., 1989, p. 166.
H. Г. Букун.


