ЭДМАНА ДЕГРАДАЦИЯ, определение первичной структуры белков и пептидов путем последоват. (ступенчатого) расщепления их пептидных связей (начиная с N-конца молекулы) действием фенилизотиоцианата:
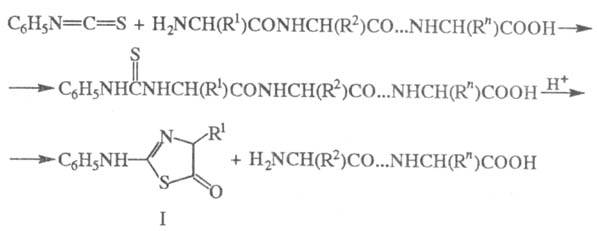
Р-цию осуществляют при рН 9 и т-ре 40 °С.
В результате образуется производное 2-анилино-5-тиазолинона (ф-ла I) и
белок (пептид), укороченный на один остаток аминокислоты.
Относительно неустойчивое производное
2-анилино-5-тиазолинона непригодно для идентификации аминокислоты. Оно
м. б. превращено в изомерный 1-фенилимидазолидин (тиогидантоин; II) при
нагр. в кислой среде или путем гидролиза (с размыканием цикла и послед.
циклизацией):
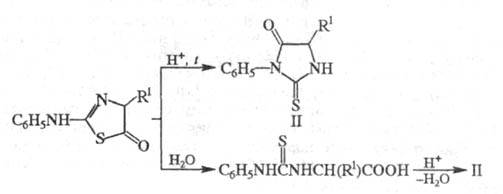
Соед. II экстрагируется и м. б. идентифицировано
с помощью бумажной, тонкослойной или газожидкостной хрома-тографии. Количественно
это соед. можно определить спектрофотометрически при 265-270 нм. Оставшийся
белок (пептид) выделяется и подготавливается к следующему циклу деградации.
Значение Э. д. возросло в связи с возможностью
осуществлять все стадии р-ции в спец. приборе - секвенаторе (от англ. sequence
- последовательность; см. также Белки)в автоматич. режиме. Для
этого белок (пептид) в виде тонкой пленки распределяют на внутр. пов-сти
стенки вращающегося сосуда. Все необходимые реагенты поступают на его дно.
Образующееся на каждой стадии производное 2-анилино-5-тиазолинона собирается
отдельно с помощью коллектора фракций для послед. идентификации. Для определения
состава аминокислотных остатков в белке (пептиде) достаточно менее 1 мг
продукта.
Созданный в 1966 П. Эдманом с использованием
этих принципов прибор и применение масс-спектрометра в сочетании с ЭВМ
позволяют полностью автоматизировать процесс определения первичной структуры
макромолекул.
Среди модификаций Э. д. широкое применение
нашел метод с использованием дансилхлорида (ДНС; 1-диметиламинонафталин-5-сульфохлорид)
- т. наз. метод ДНС-Эдмана. Он основан на р-ции ДНС с непротонированной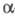 -аминогруппой
N-концевой аминокислоты белка (пептида) с образованием дансил-белка (пептида),
к-рый на следующей стадии гидролизуют с освобождением
-аминогруппой
N-концевой аминокислоты белка (пептида) с образованием дансил-белка (пептида),
к-рый на следующей стадии гидролизуют с освобождением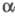 -ДНС-аминокислот
(последние обладают интенсивной флуоресценцией,
-ДНС-аминокислот
(последние обладают интенсивной флуоресценцией, 365 нм). Модификация предложена В. Греем и Б. Хартли в 1963 и также реализована
в автоматич. приборах, в т. ч. твердофаз-ных секвенаторах, в к-рых белок
ковалентно связан с полимерным носителем.
365 нм). Модификация предложена В. Греем и Б. Хартли в 1963 и также реализована
в автоматич. приборах, в т. ч. твердофаз-ных секвенаторах, в к-рых белок
ковалентно связан с полимерным носителем.
Р-ция предложена П. Эдманом в 1950.
Лит.: Общая органическая химия,
пер. с англ., т. 10, М., 1986, с. 266-67; Овчинников Ю.А., Биоорганическая
химия, М., 1987, с. 57-67; Ed-man P., "Acta Chem. Scand.", 1950, v. 4,
№ 2, p. 277-82; Folkers К. [а. о.], "Angew. Chem. Internal. Edn.", 1973,
v. 12, № 4, p. 255. В. В. Баев.


