ШТРЕККЕРА РЕАКЦИИ, 1) получение
a-аминокислот
из альдегидов или кетонов действием NH3 и HCN с послед. гидролизом
образующихся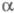 -аминонитрилов
(т. наз. синтез Штреккера):
-аминонитрилов
(т. наз. синтез Штреккера):
В р-цию вступают алифатич., алициклич.
и ароматич. альдегиды и кетоны. Если вместо NH3 использовать
первичные или вторичные амины, то образуются N-замещенные -аминокислоты.
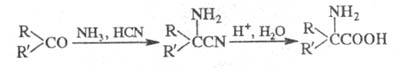
Ш. р. осуществляют последоват. смешением исходных реагентов (к карбонильному
соед. добавляют NH3, а затем HCN - классич. вариант Ш. р.),
введением всех трех реагентов в р-цию одновременно или превращением карбонильного
соед. на первой стадии в циангидрин; иногда последний вариант наз. модификацией
Тимана;
-аминокислоты.
Ш. р. осуществляют последоват. смешением исходных реагентов (к карбонильному
соед. добавляют NH3, а затем HCN - классич. вариант Ш. р.),
введением всех трех реагентов в р-цию одновременно или превращением карбонильного
соед. на первой стадии в циангидрин; иногда последний вариант наз. модификацией
Тимана;
Вместо HCN используют также NaCN в фосфатном
буферном р-ре, (CH3)3SiCN в присут. катализаторов
(А1С13, ZnI2), смесь MCN (M = Na, К) с NH4C1
(Зелинского-Стадникова
реакция).
Карбонильные соед. могут вводиться в Ш.
р. в виде би-сульфитного производного; в нек-рых случаях
a-диалкиламинонитрилы
можно получать с высоким выходом действием HCN или водного р-ра NaCN на
соли иминов.
Получение -аминонитрила
обычно ведут при умеренной т-ре (20-50 °С) в р-рителе [в случае использования
HCN или (CH3)3SiCN - в диэтиловом эфире или бензоле;
при применении др. цианидов - в воде]. Нагреванием с соляной к-той a-аминонитрил
превращается в
-аминонитрила
обычно ведут при умеренной т-ре (20-50 °С) в р-рителе [в случае использования
HCN или (CH3)3SiCN - в диэтиловом эфире или бензоле;
при применении др. цианидов - в воде]. Нагреванием с соляной к-той a-аминонитрил
превращается в -аминокислоту.
Выходы достигают 70-80%. Осн. побочные продукты - олигомеры.
-аминокислоту.
Выходы достигают 70-80%. Осн. побочные продукты - олигомеры.
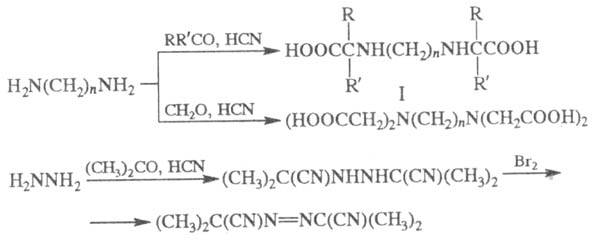
Из алкилендиаминов в условиях Ш. р. образуются
соед. ф-лы I или алкилендиаминотетрауксусные к-ты, из гидразина получают
азосоед., напр.:
Предполагают, что в Ш. р. на промежут.
стадии образуются азометины, присоединение к к-рым HCN приводит к -ами-нонитрилам.
-ами-нонитрилам.
Ш. р. используют в пром-сти и лаб. практике
для получения метионина, аланина, валина и др. Р-ция открыта А. Штреккером
в 1850.
Лит.: Mapч Дж., Органическая химия,пер. с англ., т. 3, М., 1987, с. 410-11.
2) Превращение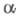 -аминокислот
в альдегиды или кетоны под действием
-аминокислот
в альдегиды или кетоны под действием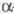 -дикарбонильных
соед. (в т. ч. циклических):
-дикарбонильных
соед. (в т. ч. циклических):
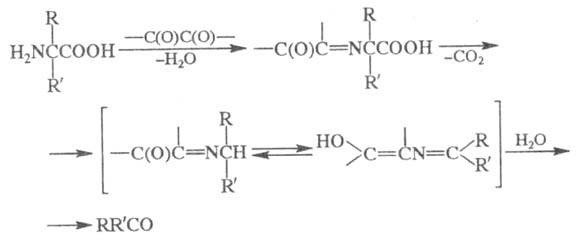
Образующиеся альдегид или кетон содержат
на один атом С меньше, чем исходная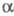 -аминокислота.
-аминокислота.
Р-цию проводят в р-рителе (напр., в водном
глицерине) при умеренном нагревании или без р-рителя при 180-220 С. Выходы
альдегидов или кетонов ок. 60%.
Осн. побочный процесс - олигоконденсация
карбонильных и аминосоединений.
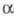 -Аминокислоты м. б. также превращены в альдегиды или кетоны под действием
окислителей (О3, Н2О2, Ag2O,
персульфатов, N-бромсукцинимида, надкислот и др.).
-Аминокислоты м. б. также превращены в альдегиды или кетоны под действием
окислителей (О3, Н2О2, Ag2O,
персульфатов, N-бромсукцинимида, надкислот и др.).
Ш. р. используют в лаб. практике, она
открыта А. Штреккером в 1862.
Лит.: Общая органическая химия,пер. с англ., т. 4, М., 1983, с. 243-44.
3) Получение солей алифатич. сульфокислот взаимод. алкилгалогенидов с щелочными сульфитами
RHal + M2SO3 RSO3M
RSO3M
Hal = Cl, Br, I; M = К, Na, NH4
В р-цию вступают первичные и вторичные алкилгалогениды, галогензамещ. к-ты, спирты и кетоны; третичные алкилгалогениды дают в осн. олефины. наиб. легко реагируют первичные алкилиодиды и алкилбромиды. Р-цию проводят в р-рителе (напр., Н2О, СН3ОН) при натр. Выходы первичных алкилсульфокислот 70-90%, вторичных - 20-25%. Осн. побочные продукты - олефины и продукты их дальнейших превращений. Р-ция открыта в 1868.
Лит.: Джильберт Э., Сульфирование органических соединений, пер. с англ., М., 1969, с. 129-36.
Г. И. Дрозд.


