ЦИКЛООЛЕФИНЫ (циклоалкены, циклены),
ненасыщ. моноциклич. углеводороды общей ф-лы СnН2n_2.
Ц. и их производные относятся к алициклическим соединениям. По числу
атомов С в цикле Ц. подразделяют на малые (3 и 4 атома), обычные (5-7),
средние (8-12) и большие (13 и более). Названия Ц. образуют из названий
соответствующих циклоалканов, заменяя окончание "ан" на "ен", напр. циклооктен.
Многие природные соед.- функциональные
производные Ц. Так, из масла семян Sterculia foetida выделена стеркуловая
к-та [8-(2-октилциклопропенил)октановая к-та], из губки Calyx nicadensis
- калистерол - производное холестерина, содержащее в молекуле циклопропеновое
кольцо. Из прир. источников выделен также антибиотик пинитрицин (гидроксиметилциклопропенон);
один из распространенных орг. объектов в космич. пространстве - карбен
циклопропенилиден.
Низшие Ц.- циклопропен и циклобутен -
газы, остальные Ц.- жидкости (табл.), не раств. в воде, хорошо раств. в
большинстве орг. р-рителей (углеводороды, спирты, простые и сложные эфиры).
Жидкие Ц. часто образуют азеотропные смеси с разл. соед., напр. для циклогексена
известны азеотропные смеси с водой, метанолом, этанолом, уксусной к-той,
бензолом.
СВОЙСТВА НЕКОТОРЫХ ЦИКЛООЛЕФИНОВ
|
Соединение
|
Мол.м.
|
Т.пл., °С
|
Т.КИП., °С
|
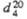 |
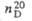 |
|
Циклопропен
|
40,06
|
_
|
-36
|
_
|
_
|
|
Циклобутен
|
54,09
|
_
|
2,0
|
0,732
|
_
|
|
Циклопентен
|
68,11
|
-135,1
|
44,2
|
0,7720
|
1,4225
|
|
Циклогексен
|
82,14
|
-103,51
|
82,98
|
0,8102
|
1,4465
|
|
Циклооктен
транс- |
110,19
|
-59
|
143
|
0,8472
|
1,4741*
|
|
цис-
|
То же
|
-12
|
138
|
0,8472
|
1,4698
|
|
Циклододецен
|
166,30
|
—
|
100-103**
|
—
|
1,4864
|
*При 25 oС. **При 11 мм рт. ст.
Особенности строения Ц. (размер цикла и
геометрия фрагмента С = С) м. б. выявлены с помощью спектров ПМР: хим.
сдвиг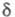 7,01 (=СН) и 0,92 (=ССН2) м. д. для циклопропена, 6,03 и 2,57
м.д. для циклобутена, 5,60 и 2,28 м.д. для циклопентена, 5,59 и 1,96 м.
д. для циклогексена, 5,56 и 2,11 м.д. для циc-циклооктена, для транс-циклооктена
хим. сдвиг
7,01 (=СН) и 0,92 (=ССН2) м. д. для циклопропена, 6,03 и 2,57
м.д. для циклобутена, 5,60 и 2,28 м.д. для циклопентена, 5,59 и 1,96 м.
д. для циклогексена, 5,56 и 2,11 м.д. для циc-циклооктена, для транс-циклооктена
хим. сдвиг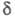 5,40 м. д. (=СН).
5,40 м. д. (=СН).
В отличие от транс-олефинов, обладающих
большей стабильностью, чем соответствующие цис-изомеры, относит.
стабильность цис- и транс-циклоолефинов меняется в зависимости от
размера цикла. Для малых и обычных циклов стабильны лишь цис-изомеры,
к-рые можно выделить в индивидуальном состоянии; транс-изомеры С3
- С7 обладают значительно большим запасом энергии и потому более
реакционноспособны. Начиная с циклооктена с увеличением размера цикла стабильность
транс-изомеров увеличивается. Кроме того, у таких Ц. появляется хиральность.
Так, разделение рацемич. транс-циклооктена с помощью платиновых
комплексов, содержащих оптически активный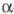 -фенилэтиламин,
приводит к достаточно стабильным D- и L-энантиомерам: активац. барьер рацемизации
149,07 кДж/моль. Стабильность энантиомеров транс-циклононена и транс-циклодецена
невысока из-за значительно большей конформац. подвижности полиметиленовых
цепочек.
-фенилэтиламин,
приводит к достаточно стабильным D- и L-энантиомерам: активац. барьер рацемизации
149,07 кДж/моль. Стабильность энантиомеров транс-циклононена и транс-циклодецена
невысока из-за значительно большей конформац. подвижности полиметиленовых
цепочек.
Реакц. способность Ц., изменяющаяся в
широких пределах, определяется размером цикла, его конформац. особенностями
и изомерией относительно связи С = С. наиб. реакционноспособны циклопропен
и циклобутен благодаря высокой энергии напряжения малого цикла (см. Напряжение
молекул). Так, циклопропен, его моно-и многие 1,3-дизамещенные производные
вступают в еновые реакции при низких т-рах (р-ция 1); легко металлируются
под действием оснований (литийорг. соед., амиды металлов и др.) при наличии
хотя бы одного атома Н у атомов С-1 или С-2 (2); образуют соли циклопропенилия
в результате отрыва галогена или гидрид-иона от атома С-3 циклопропенов
(3); в условиях термич., каталитич. и фотохим. р-ций способны генерировать
алкенилкарбены (4):
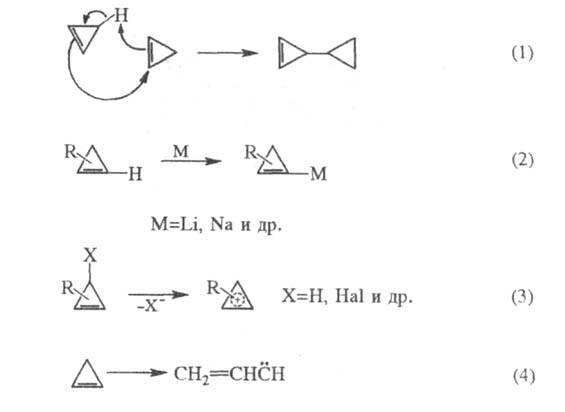
Циклобутен при нагр. до 180 °С изомеризуется количественно в 1,3-бутадиен. Такое раскрытие производных циклобутена часто используют для синтеза разнообразных 1,3-диенов. Особый интерес представляют стереоселективные превращения 3,4-дизамещенных циклобугенов в 1,4-дизамещенные 1,3-бутадиены:
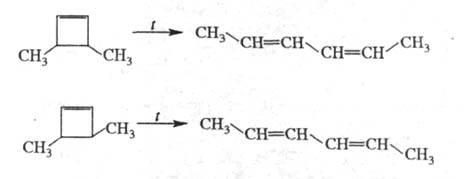
Ц. вступают в р-ции каталитич. гидрирования, присоединяют галогены, окисляются надкислотами с образованием соотв. циклоалканов, 1,2-дигалогенпроизводных и эпоксидов:
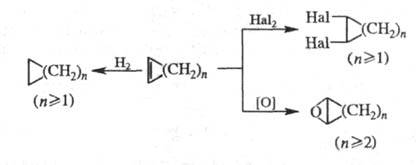
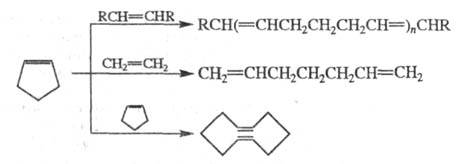
В условиях р-ций метатезиса Ц. расщепляются, образуя ациклич. полимерные, мономерные и циклич. продукты, напр.:
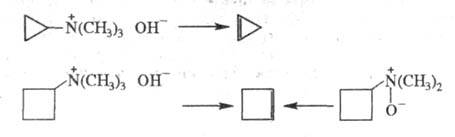
Ц. получают с помощью р-ций элиминирования, используя доступные замещенные циклоалканы. Так, циклопропен и циклобутен получают термич. разложением четвертичных аммониевых оснований в условиях р-ции Гофмана либо термич. разложением N-оксидов третичных аминов:
Циклопропены м. б. получены также присоединением
карбенов по связям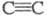 (см. Карбены). Для синтеза замещенных циклобутенов используют внутри-
или межмол. фотохим. [2 + 2]-циклоприсоединение производных этилена и ацетилена:
(см. Карбены). Для синтеза замещенных циклобутенов используют внутри-
или межмол. фотохим. [2 + 2]-циклоприсоединение производных этилена и ацетилена:
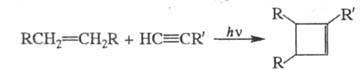
Циклопентен и циклогексен получают обычно
дегидратацией соответствующих циклоалканолов, используя в качестве дегидратирующих
средств А12О3 или силикагель при повышенных т-рах,
а в лаборатории - H2SO4 либо Н3РО4.
Циклопентен м. б. получен гидрированием циклопентадиена на Pd-катализаторах.
Для синтеза циклооктена и циклододецена
используют селективное гидрирование соотв. 1,5-циклооктадиена и 1,5,9-циклододекатриена
в присут. Ni-катализаторов.
Ц.- полупродукты в орг. синтезе. Циклопентен
- сырье для получения каучука, циклогексен - алкилирующий агент, р-ритель,
применяется для синтеза малеиновой, адипиновой, циклогексанкарбоновой к-т
и циклогексанкарбальдегида; в лаборатории - для синтеза бутадиена.
См. также Циклопентен.
Лит.: Марч Дж., Органическая химия,


