ЦИКЛООКТАТЕТРАЕН (ф-ла I), мол.
м. 104,14; золотисто-желтая жидкость; т. пл. -7 °С, т. кип. 142 °С,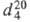 0,9206;
0,9206;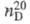 1,5375;
1,5375;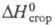 -4475,7 кДж/моль;
-4475,7 кДж/моль;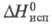 43,12 кДж/моль. Длины связей в молекуле (нм): С = С 0,13, С—С 0,146, С—Н
0,109, углы С = С—Н 118,3°, С = С—С 126,46°.
43,12 кДж/моль. Длины связей в молекуле (нм): С = С 0,13, С—С 0,146, С—Н
0,109, углы С = С—Н 118,3°, С = С—С 126,46°.
Ц. проявляет св-ва ненасыщ. соед.: легко
присоединяет водород, галогены, окисляется.
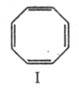
Гидрирование приводит к продуктам частичного или полного восстановления; р-цию используют в синтезе пробковой к-ты:
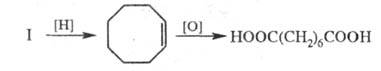
При хлорировании Ц. при т-ре от -30 до 0 °С образуется гл. обр. 2,3,4,5,7,8-гексахлорбицикло[4.2.0]октан, а при действии SO2C12 - 7,8-дихлорбицикло[4.2.0]окта-2,4-диен; последний при гидрировании превращается в бицикло[4.2.0]октан:
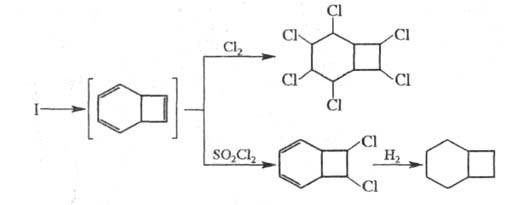
Надкислоты окисляют Ц. до эпоксида, при гидрировании к-рого образуется циклооктанол:
Окисление Ц. гипохлоритами в щелочной среде
приводит к терефталевому альдегиду, хромовым ангидридом в уксусной к-те
- к терефгалевой к-те.
При длительном кипячении в атмосфере азота
Ц. димери-зуется по схеме диенового синтеза, в более жестких условиях -
полимеризуется.
Получают Ц. тетрамеризацией ацетилена
в присут. солей Ni при 50-60 °С под давлением в среде ТГФ.
Применяют Ц. для получения циклооктана,
циклооктена и др. соед. этого ряда.
Лит.: Химия ацетилена. Сб., пер. с англ, и нем., М., 1954; Schroder G., Cyclooctatetraen, Weinheim, 1965.
Э. Е. Нифантъев.


