ХРОМ (от греч. chroma - цвет, краска;
из-за яркой окраски соед.; лат. Chromium) Сг, хим. элемент VI гр. периодич.
системы, ат. н. 24, ат. м. 51,9961. Природный X. состоит из смеси 4 изотопов
50Сr
(4,35%), 52Сr (83,79%), 53Сr (9,50%) и 54Сr
(2,36%). Поперечное сечение захвата тепловых нейтронов для X. 3,1 x 10-28
м2.
Конфигурация внеш. электронных оболочек
атома 3d54s1; степени окисления +2,
+3, +6, реже +4, +5 и +1; энергия ионизации при переходе от Сr0
к Сr6+ 6,766, 16,49, 30,96, 49,1, 69,3 и 90,6 эВ; сродство к
электрону 1,6 эВ; электроотрицательность по Полингу 1,66; атомный радиус
0,127 нм, ионные радиусы, в нм (в скобках указаны координац. числа): для
Сr2+ 0,073 (6), Сr3+ 0,0615 (6), Сr4+
0,041 (4), 0,055 (6), Сr5+ 0,0345 (4), 0,049 (6) и 0,057 (8),
для Сr6+ 0,026 (4) и 0,044 (6).
Содержание X. в земной коре 0,035% по
массе, в воде морей и океанов 2 x 10-5 мг/л. Известно более
40 минералов X., из них для извлечения X. используют только хромит FeCr2O4,
точнее хромшпинелиды (Mg, Fe)(Cr, Al, Fe)2O4. Нек-рые
др. минералы: крокоит РbСrO4, волконскоит Cr2Si4O10(OH)2
xnH2O,
уваровит Са3Сr2(SiO4)3, вокеленит
Pb2Cu[CrO4]PO4, феникохроит Рb3О(СrO4)2.
Сульфидные минералы X. обнаружены в метеоритах.
Свойства. X.- голубовато-белый металл.
Кристаллич. решетка объемноцентрированная кубич. а = 0,28845 нм,
z = 2, пространств, группа 1тЗт. При 312 К (точка Нееля)
переходит из парамагнитного в антиферромагнитное состояние. Еще один переход
(без изменения структуры) фиксируется при 170-220 К. Т. пл. 1890 °С, т.
кип. 2680 °С; плотн. 7,19 г/см3;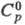 23,3 Дж/(моль x К);
23,3 Дж/(моль x К);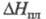 21 кДж/моль,
21 кДж/моль, 338 кДж/моль;
338 кДж/моль;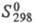 23,6
Дж/(моль x К); ур-ния температурной зависимости давления пара для твердого
X. lgp (мм рт. ст.) = = 11,454 - 22598/T - 0,406 lgT +
0,781T (298 - 2163 К), для жидкого X. lgp (мм рт. ст.) =
9,446 - 18204/T+ 0,114 lg Т (2163 — 2950 К); температурный
коэф. линейного расширения 4,1 x 10-6 К-1; теплопроводность
88,6 Вт/(м x К); р 0,15 x 10-6 Ом x м, температурный козф.
23,6
Дж/(моль x К); ур-ния температурной зависимости давления пара для твердого
X. lgp (мм рт. ст.) = = 11,454 - 22598/T - 0,406 lgT +
0,781T (298 - 2163 К), для жидкого X. lgp (мм рт. ст.) =
9,446 - 18204/T+ 0,114 lg Т (2163 — 2950 К); температурный
коэф. линейного расширения 4,1 x 10-6 К-1; теплопроводность
88,6 Вт/(м x К); р 0,15 x 10-6 Ом x м, температурный козф.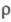 3,01 x 10-3 К-1. Парамагнитен, магн. восприимчивость
+3,49 x 109. Модуль нормальной упругости (для отожженного X.
высокой чистоты) 288,1 ГПа;
3,01 x 10-3 К-1. Парамагнитен, магн. восприимчивость
+3,49 x 109. Модуль нормальной упругости (для отожженного X.
высокой чистоты) 288,1 ГПа;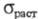 410 МПа; относит. удлинение 44%; твердость по Бринеллю 1060 МПа. X. техн.
чистоты хрупок, приобретает пластичность выше 200-250 °С.
410 МПа; относит. удлинение 44%; твердость по Бринеллю 1060 МПа. X. техн.
чистоты хрупок, приобретает пластичность выше 200-250 °С.
Стандартный электродный потенциал -0,74
В (относительно р-ра Сr3+). X. устойчив на воздухе (однако тонкоизмельченный
пирофорен) и к действию воды. Нагретый в кислороде до ~ 300 °С сгорает
с образованием Сr2О3 (см. Хрома оксиды). Раств.
в соляной и разб. серной к-тах. В конц. HNO3, HC1O4,
Н3РО4 и под действием окислителей легко пассивируется.
Пассивный X. очень устойчив. Р-ры щелочей на X. не действуют, расплавленные
щелочи в отсутствие воздуха очень медленно реагируют с выделением Н2.
Фтор действует на X. выше 350 °С. Сухой
хлор начинает реагировать с л. выше 300 °С, влажный хлор начинает действовать
уже с 80 °С. Бром и иод действуют на X. при т-ре красного каления, также
как HF и НС1. См. Хрома галогениды.
С водородом X. непосредственно не взаимодействует.
Р-римость Н2 в X. 0,44 ат. % при 800 °С, но электролитич. X.
может содержать значительно большие кол-ва
- до 300 объемов на объем металла. Путем электролиза можно получить и гидриды-
СrН с гексагон. решеткой и кубич. гидрид, чей состав приближается к СrН2.
Эти металлоподобные гидриды при нагр. легко теряют водород.
Азот поглощается тонким порошком X. при
800-1000 °С с образованием нитрида CrN, а при 1200-1300 °С - Cr2N.
Но обычно эти нитриды (табл.) получают действием NH3 на X. (при
~ 850 °С). Нитриды, особенно CrN, обладают высокой хим. стойкостью. Их
используют как компоненты твердых сплавов, катализаторы, а мононитрид -
как полупроводниковый материал для термоэлектрич. генераторов. X. сплавляется
с бором, углеродом и кремнием с образованием соотв. боридов, карбидов и
силицидов. Их применяют как компоненты твердых, жаростойких сплавов, износоустойчивых
и химически стойких покрытий. С оксидами углерода X. не взаимодействует.
СВОЙСТВА НЕКОТОРЫХ СОЕДИНЕНИЙ ХРОМА
|
Соединение
|
Сингония
|
Параметры решетки,
им
|
Т.пл., °С
|
Плотн.,
г/см3 |
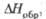
кДж/моль |
|||
|
а
|
b
|
с
|
||||||
|
Сr2В
|
Ромбич.
|
1,471
|
0,741
|
0,425
|
1870
|
6,07
|
_
|
|
|
Сr5В3
|
Тетрагон.
|
0,546
|
—
|
1,064
|
1890"
|
6,03
|
—
|
|
|
СrВ
|
Ромбич.
|
0,2969
|
0,7858
|
0.2932
|
2090
|
6,17
|
—
|
|
|
Сr3В4
|
"
|
0,2986
|
1,302
|
0,2952
|
2070
|
5,22
|
—
|
|
|
СrВ2
|
Гексагон.
|
0,2969
|
_
|
0,3066
|
2200
|
5,6
|
-125,6
|
|
|
CrB4
|
Ромбич.
|
0,4744
|
0,5477
|
ОД866
|
1600б
|
_
|
_
|
|
|
Сr23С6
|
Кубич.
|
1,0638
|
_
|
_
|
1520
|
7,0
|
-209,4
|
|
|
Сr7С3
|
Гексагон.
|
1,398
|
—
|
0,4532
|
1780
|
6,9
|
-178
|
|
|
Сr3С2
|
Ромбич.
|
0,2821
|
0,552
|
1,146
|
1895
|
6,68
|
-88
|
|
|
Cr3Si
|
Кубич.
|
0,4564
|
—
|
—
|
1770
|
—
|
-138
|
|
|
Cr5Si3
|
Тетрагон.
|
0,9178
|
—
|
0,4659
|
1680
|
5,5
|
-327
|
|
|
CrSi
|
Кубич.
|
0,4629
|
_
|
_
|
1475a
|
5,37
|
-71
|
|
|
CrSi2
|
Гексагон.
|
0,4422
|
—
|
0,6351
|
1490
|
-101
|
||
|
Cr2N
|
Гексагон.
|
0,4806
|
—
|
0,4479
|
1650
|
6,5
|
-128,6
|
|
|
CrN
|
Кубич.
|
0,4148
|
—
|
—
|
1500б
|
5,8
|
-123,4
|
|
аИнконгруэнтао. бС разложением.
Пары S действуют на X. при т-рах выше 400
°С с образованием серии сульфидов от CrS до Cr5S8.
Сульфиды образуются также при действии H2S (~ 1200 °С) и паров
СS2. При сплавлении с Se X. дает селениды, по составу аналогичные
сульфидам. Теллуриды имеют состав от СrТе до CrTe3. Металлы
с сексвихалькогенидами Сr2Х3 дают халькогенохроматы(III).
Большинство из них обладает полупроводниковыми св-вами и являются либо
ферромагнетиками, либо антиферромагнетиками. Соед. с одновалентными металлами
состава МСrХ2 большей частью имеют ромбоэдрич. решетку типа
NaHF2. Для К, Rb и Cs известны также соед. типа MCr5S8.
Двухвалентные металлы образуют соед. состава МСr2Х4,
почти все они имеют структуру шпинели, часть их при высоких т-рах и давлениях
переходит в структуру типа NiAs. Для РЗЭ известны соед. типа МСrХ3.
Для X. характерна способность к образованию
многочисленных комплексных соед. в разных степенях окисления. Образование
комплексов стабилизирует низшие степени окисления X. Так, Сr(I) известен
только в виде комплексов, напр. K3[Cr(CN)5NO]. Соед.
Сr(II) неустойчивы, это сильные восстановители, легко окисляются на воздухе.
Их водные р-ры (небесно-голубого цвета, тогда как безводные соли бесцветные)
сохраняются только в инертной атмосфере. Из р-ров кристаллизуются гидраты,
напр. Сr(СlO4)2 x 6Н2О. Из
комплексов Сr(II) самый распространенный синий K4[Cr(CN)6],
дающий красно-оранжевые р-ры.
Соед. Cr(III) наиб. устойчивы. В водных
р-рах катион Сr(III) существует в виде инертного аквакомплекса [Сr(Н2О)6]3+
с очень малой скоростью обмена молекул воды на др. лиганды. Вследствие
этого соли в р-рах и в кристаллич. состоянии существуют в виде разноокрашенных
изомеров -фиолетовых, содержащих указанный гексааквакатион, и зеленых,
в к-рых анионы входят во внутр. сферу комплекса. Известно множество комплексов
Сr(III) с координац. числом 6 и октаэдрич. конфигурацией, в большинстве
химически инертных. К их числу относятся комплексы с нейтральными лигандами
(из них наиб. изучены аммины) и с разнообразными анионами (галогенидные,
цианидные, роданидные, сульфатные, оксалатные и др.). Характерны полиядерные
формы комплексов с гидроксидными, кислородными, амминными, роданидными
мостиками.
Нитрат Cr(NO3)3 x9H2O
- пурпурные или темно-фиолетовые кристаллы; т. пл. 66 С, т. разл. 125 °С,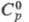 455 Дж/(моль х К);
455 Дж/(моль х К);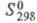 507 Дж/(моль х К). Хорошо раств. в воде (44,8% по массе при 25 °С. в пересчете
на безводную соль), этаноле и ацетоне, фиолетовый водный р-р при кипячении
зеленеет. Описаны светло-голубой безводный нитрат, а также гидраты Cr(NO3)3
х
nH2O:
красновато-фиолетовый, п = 12,5; темно-коричневый и фиолетовый,
п
= 7,5; голубовато-зеленый, п = 3 и др. Получают нитрат взаимод.
Сr(ОН)3 с HNO3 или Ca(NO3)2
с Cr2(SO4)3 в водном р-ре; применяют как
протраву при крашении тканей, добавку при синтезе катализаторов.
507 Дж/(моль х К). Хорошо раств. в воде (44,8% по массе при 25 °С. в пересчете
на безводную соль), этаноле и ацетоне, фиолетовый водный р-р при кипячении
зеленеет. Описаны светло-голубой безводный нитрат, а также гидраты Cr(NO3)3
х
nH2O:
красновато-фиолетовый, п = 12,5; темно-коричневый и фиолетовый,
п
= 7,5; голубовато-зеленый, п = 3 и др. Получают нитрат взаимод.
Сr(ОН)3 с HNO3 или Ca(NO3)2
с Cr2(SO4)3 в водном р-ре; применяют как
протраву при крашении тканей, добавку при синтезе катализаторов.
Соед. Cr(IV) немногочисленны - это простые
и комплексные галогениды, а также хроматы(IV). Cr(V) реализуется в осн.
в оксогалогенидах, напр, в CrOF3, в хроматах(V) и в галогенохроматах
типа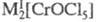 или M[CrOF4]. Cr(VI) образует многочисленные хроматы. В
р-рах он может присутствовать в виде ионов СrО3Х-,
где X - галоген, CrO3(OSO3)2- и т. д.
Соед. Cr(VI) - сильные окислители. См. также Хрома карбонилы, Хрома
сульфаты, Хроморганические соединения.
или M[CrOF4]. Cr(VI) образует многочисленные хроматы. В
р-рах он может присутствовать в виде ионов СrО3Х-,
где X - галоген, CrO3(OSO3)2- и т. д.
Соед. Cr(VI) - сильные окислители. См. также Хрома карбонилы, Хрома
сульфаты, Хроморганические соединения.
Определение. X. относится к аналит.
группе (NH4)2S. Для его обнаружения применяют р-ции
с Н2О2 (синее окрашивание вследствие образования
надхромовой к-ты), хромотроповой к-той (красное окрашивание), бензидином
(синее окрашивание).
Для определения X. используют титриметрич.
методы -титрование р-ром соли Мора (NH4)2Fe(SO4)2
x6H2O
после предварит. окисления Сr(III) персульфатом аммония, Н2О2
и др. Для определения Сr(III) применяют комплексонометрич. метод (обратное
титрование избытка комплексона разл. солями), потенциометрич. и амперометрич.
титрование.
Для определения малых концентраций X.
используют фотометрич. методы, гл. обр. основанные на р-ции с дифенилкарбазидом
(красно-фиолетовое окрашивание). Методы, основанные на собств. окраске
ионов Сr(III), хромат- и дихромат-ионов, а также синей окраске надхромовой
к-ты, менее чувствительны.
Известны полярографич., люминесцентные,
кинетич. методы определения X. Перспективны газохроматографич. методы с
использованием ацетилацетона и, особенно, его фторпроизводных - трифтор-
и гексафторацетилацетона.
Применяют разнообразные физ. методы определения
X., в первую очередь - спектральный анализ. Наиб. интенсивные линии спектра
X. отвечают длинам волн 425,435, 427,480 и 428,972 нм. Часто используют
также линии УФ области, напр. 283,56 и 301,48 нм. При определении малых
кол-в X. применяют методы предварит. отделения примесей и концентрирования
путем отгонки, экстракции, осаждения и т. п.
Для определения X. используются атомно-абсорбционная
спектрометрия, рентгенофлюоресцентный анализ и, особенно, радиоактивационный
анализ.
Получение. Хромитовые руды большей частью не обогащаются. Непосредств. металлургич. переработка хромитовых руд позволяет получать путем восстановит, плавки в электропечах только феррохром с содержанием 60-70% Сг (см. Хрома сплавы), используемый в черной металлургии. Имеются способы получения из феррохрома соед. X., но гл. обр. их произ-во основано на окислит. обжиге хромита с Na2CO3 и доломитом при 1100-1200 °С. Образовавшийся Na2СrО4 выщелачивают водой и после очистки р-ра от А1 действием H2SO4, CO2 или Na2Cr2O7 из р-ра кристаллизуют либо Na2CrO4, либо Na2Cr2O7, либо р-р перерабатывают на др. соед. X. Необходимый для получения металлич. X. Сr2О3 получают восстановлением щелочного р-ра Na2CrO4 элементарной серой при кипячении или в автоклавах при 140-160 °С по р-ции:
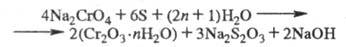
Затем р-р подкисляют H2SO4 и проводят вторую стадию восстановления с получением хромихромата или гидроксида Сr(II):
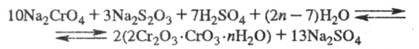
После сушки и прокаливания гидроксидных
осадков получают Сr2О3.
Металлич. X. большей частью производят
восстановлением Сr2О3 алюминием или элементарным
кремнием. Реже используют восстановление углеродом, при к-ром получают
X. с большим содержанием С. Предложены также процессы восстановления СrС13
магнием. Более чистый X. получают электролизом либо сернокислых р-ров СrО3,
либо р-ров хромоаммониевых квасцов.
Для рафинирования X. применяют обработку
сухим или влажным Н2 при высоких т-рах, вакуумную дистилляцию,
зонную плавку, иодидное рафинирование. Для получения особо чистого X. предложено
использовать термич. разложение opг. комплексов, напр. бис(этилбензол)хрома
с послед. водородной очисткой металла.
X. применяют в металлургии, в осн. как
компонент сталей разл. назначения, в частности нержавеющих. X. входит в
состав жаропрочных сплавов на основе Ni и Со. Большие кол-ва X. используют
для получения хромовых покрытий. Помимо высокой коррозионной стойкости
они обладают большим сопротивлением истиранию. Разл. соед. X. применяют
в качестве огнеупорных материалов, пигментов, дубителей кожи, протрав при
крашении, реактивов, магн. материалов и др. Соотношение областей использования:
металлургия 75%, огнеупоры 10%, прочее 15%.
Мировая добыча хромитовых руд и концентратов
(без России) ок. 12 млн. т в год; выплавка феррохрома 2,7 млн. т в год;
произ-во металлич. X. ок. 20 тыс. т в год (1990). Осн. производители -
США, Япония, ЮАР, Германия, Франция, Италия, Великобритания.
Металлич. X. малотоксичен, также малоадовиты
соед. X. низших степеней окисления [но в организме они могут перейти в
соед. Cr(VI)]. Соед. Cr(VI) обладают местным и общетоксич. действием, вызывают
поражение органов дыхания, кожи, слизистых оболочек, желудочно-кишечного
тракта. Попадают в кровь, откладываются в печени, почках, эндокринных железах,
зубах. ПДК (в пересчете на СrО3) 0,01 мг/м3, Сг6+
0,0015 мг/м3 (атм. воздух). X. открыт Л. Вокленом в 1797.
Лит.: Плинер Ю. Л., Игнатенко Г. Ф., Лаппо С. И., Металлургия хрома, М., 1965; Салли А., Брэидз Э., Хром, пер. с англ., 2 изд., М., 1971; Авербух Т. Д., Павлов П. Г., Технология соединений хрома, 2 изд., М., 1973; Лаврухина А. К., Юкина Л. В., Аналитическая химия хрома, М., 1979; Неорганические соединения хрома, Л., 1981.
П. И. Федоров.


