ХЛОРМЕТИЛИРОВАНИЕ, введение хлорметильной группы СН2С1 в молекулу орг. соед. Особенно гладко протекает X. ароматич. соед. (р-ция Блана). Р-цию осуществляют действием формальдегида и НС1 в присут. к-т Льюиса или протонных к-т (ZnCl2, A1C13, SnCl4, H2SO4, H3PO4), напр.:
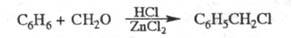

Вместо формальдегида можно использовать
триоксиметилен, параформ, ацетали формальдегида. Легкость р-ции зависит
от природы заместителей; электронодонорные заместители ускоряют р-цию.
Легко хлорметилируется нитробензол, м-динитробензол в р-цию не вступает.
X. аминов и фенолов приводит к полимерным продуктам. X. нафталина протекает
в присут. ледяной СН3СООН и Н3РО4.
При X. ароматич. соед. могут образовываться
соед., содержащие 2, 3 (и более) хлорметильные группы; для получения монозамещенного
продукта применяют 4-5-кратный избыток исходного соед.
Механизм X. включает образование гидроксиметилпроизводного,
к-рое далее под действием НС1 превращается в хлорметилзамещенное соед.;
атакующим электрофилом служит гидроксиметил-катион:
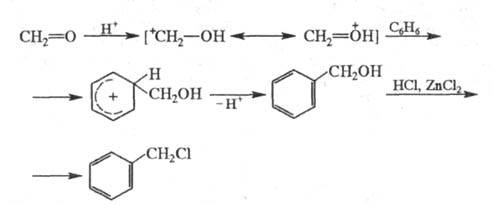
Аналогично X. осуществляют фторметилирование,
бромметилирование и иодметилирование с использованием соответствующих галогеноводородных
к-т.
X. можно проводить с помощью хлорметилалкиловых
эфиров, напр.:
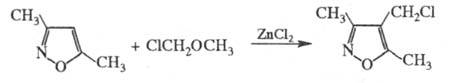
Хлорметилэтиловый эфир применяют для введения
хлорметильной группы в полистирол; р-цию проводят в диоксане в присут.
ZnCl2.
X. азотсодержащих соед. м. б. осуществлено
путем замещения атома хлора, напр.:
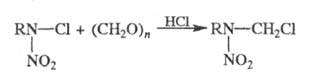
X. используют для получения бензилхлорида, хлорметильных производных ксилолов, псевдокумола и др. Р-ция предложена Г. Бланом в 1923.
Лит.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 353-55; Мищенко ГЛ., Вацуро К.В., Синтетические методы органической химии, М., 1982, с. 390-91.
Л. Н. Максимова.


