ХЛОРАТЫ, соли хлорноватой к-ты НСlO3.
Анион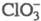 имеет
структуру тригон. пирамиды, длина связей Сl — О 0,1452-0,1507 нм, угол
ОС1О 106°. Анион С1О3 не образует ковалентных связей через атом
О и не склонен образовывать координац. связи. Существует неск. соед., к-рые
также относят к X., в них группа СlO3 связана ковалентно через
атом С1 -FСlO3,
имеет
структуру тригон. пирамиды, длина связей Сl — О 0,1452-0,1507 нм, угол
ОС1О 106°. Анион С1О3 не образует ковалентных связей через атом
О и не склонен образовывать координац. связи. Существует неск. соед., к-рые
также относят к X., в них группа СlO3 связана ковалентно через
атом С1 -FСlO3,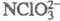 , С6Н5С1O3 и др.
, С6Н5С1O3 и др.
Хлорноватая к-та НС1О3 известна
только в водном р-ре, предельная концентрация ок. 30%, попытка получить
более конц. к-ту вакуумной отгонкой приводит к разложению и иногда взрыву;
рКа -2,7;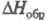 в бесконечно разб. водном р-ре -95,23 кДж/моль; при 18 oС плотн.
7,23%-ного р-ра 1,0421, 13,57%-ного 1,0829 и 25,87%-ного 1,1713 г/см3.
НС1О3 легко восстанавливается до НС1, напр.:
в бесконечно разб. водном р-ре -95,23 кДж/моль; при 18 oС плотн.
7,23%-ного р-ра 1,0421, 13,57%-ного 1,0829 и 25,87%-ного 1,1713 г/см3.
НС1О3 легко восстанавливается до НС1, напр.:

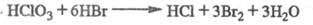
В слабокислой среде H2SO3
восстанавливает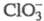 до Сl-, но при пропускании SO2, разбавленного воздухом,
в сильнокислый р-р идет р-ция:
до Сl-, но при пропускании SO2, разбавленного воздухом,
в сильнокислый р-р идет р-ция:
2HC1O3+H2SO3 2C1O2
+ H2SO4 + H2O
2C1O2
+ H2SO4 + H2O
Взаимод. солей Fе(II) в среде 5М Н3РО4 или H2SO4 с хлорат-ионом идет при 70-80 °С в присут. OsO4 и используется для количеств. определения X.:

В сильнокислой среде устанавливается равновесие:

С ростом т-ры константа равновесия увеличивается от 0,038 (10 °С) до 0,073 (60 °С). При избытке Сl- возрастает вклад р-ции:
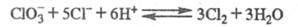
Получают НСlO3 действием H2SO4
на р-р Ва(СlO3)2 или в ионообменных колонках.
X. - энергичные окислители как в р-ре,
так и в твердом состоянии: смеси безводных X. с S, углем и др. в-вами,
способными окисляться, детонируют при быстром нагревании и ударе. Хотя
хлор в X. находится не в высшей степени окисления, окислить до
до в
водном р-ре удается только электрохимически или под действием XeF2.
O3 не окисляет X. до перхлоратов. В виде гидратов известны X.
большинства металлов, в безводном состоянии выделены X. щелочных и щел.-зем.
металлов, Ag, Тl(II), Рb(II), а также NH4Cl3, N(CH3)4C1O3
и т. п. X. металлов переменной валентности, как правило, неустойчивы и
склонны к взрывному распаду.
в
водном р-ре удается только электрохимически или под действием XeF2.
O3 не окисляет X. до перхлоратов. В виде гидратов известны X.
большинства металлов, в безводном состоянии выделены X. щелочных и щел.-зем.
металлов, Ag, Тl(II), Рb(II), а также NH4Cl3, N(CH3)4C1O3
и т. п. X. металлов переменной валентности, как правило, неустойчивы и
склонны к взрывному распаду.
Все X. щелочных металлов (табл.) разлагаются
экзотермически на МС1 и О2 с промежут. образованием перхлоратов.
Оксиды переходных металлов - MnO2, Fe2O3,
CoO, NiO и др., а также Na2O2 катализируют распад
X., снижая т-ру разложения на 100-200 °С. Выше 300 °С X. щелочных металлов
имеют небольшое собств. давление пара и м. б. возогнаны. О св-вах NaClO3
см. Натрия хлорат.
СВОЙСТВА ХЛОРАТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
|
Показатель
|
LiClO3
|
NaC1O3
|
КСlO3
|
RbClO3
|
CsClO3
|
|
Сингоння
|
_
|
Кубич.
|
Моноклинная
|
Гексагoн.
|
Гексагон.
|
|
Пространств.
группа
|
—
|
Р213
|
Р21/т
|
R3m
|
R3m
|
|
Т. пл., °С
|
129
|
263
|
357
|
342
|
388
|
|
Т-ра начала разложения,
oС
|
367
|
465
|
472
|
480
|
483
|
|
Плотн., г/см3
|
2,631
|
2,493
|
2,338
|
3,203
|
_
|
|
С0p
Дж/(моль
x К)
|
—
|
100,1
|
100,3
|
103,2
|
104,6
|
 кДж/моль
кДж/моль |
-368,3
|
-357,7
|
-389,1
|
-394,3
|
-406,8
|
|
Р-римость в воде,
г в 100г
|
406,3
|
95,89
|
8,58
|
6,61
|
7,60
|
X. лития LiClO3 гигроскопичен;
образует гидраты: LiC1O3-3H2O (т. пл. 8,5 °С), LiClO3
x H2O (т. пл. 20,5
oС, с разл.),
LiClO3 x 0,25 Н2О (т. пл. 42 °С, с разл.).
Эвтектич. смесь LiClO3 - NaClO3 имеет т. пл. 107,1
°С и содержит 69% LiС1O3. Бертоллетова соль КС1O3
при 250 °С переходит из моноклинной в ромбич. модификацию; негигроскопична,
гидратов не образует; р-римость КС1O3 в воде при 100 °С достигает
56,0 г в 100 г; выше 220 °С реагирует с газообразным NH3, образуя
KNO3, KC1, С12 и Н2О. Смеси КС1O3
с солями аммония и гидразония могут самовоспламеняться при хранении.
X. магния Mg(ClO3)2
очень гигроскопичен; р-римость в воде при 25 °С 142 г в 100 г; образует
гидраты: Mg(ClO3)2 x 2H2O (разлагается
с частичной дегидратацией выше 100 oC), Mg(C1O3)2
x
4H2O (т. пл. 65,7 °С), Mg(ClO3)2
x
6H2O (т. пл. 34,2 °С), Mg(C1O3)2
x
12H2O (т. пл. -7,5 °С). Образует также кристаллич. комплекс
с мочевиной Mg(ClO3)2 x 6CO(NH2)2.
X. кальция Са(С1O3)2 гигроскопичен; дает гидраты:
Са(С1О3)2 x 2Н2О (т. пл. 76
°С), Са(С1O3)2 x 4Н2О (т. пл.
-7,8 °С) и Са(С1O3)2 x 6Н2О
(т. пл. -26,8 °С), все они плавятся инконгруэнтно; р-римость в воде при
25 °С 194,5 г в 100 г; - 710,0 кДж/моль; получают хлорированием известкового молока при 70-80
°С. X. бария Ва(С1O3)2 - кристаллы ромбич. сингонии
(пространств. группа Fdd2); т. пл. 400 °С (с разл.; плотн. 3,347
г/см3;
- 710,0 кДж/моль; получают хлорированием известкового молока при 70-80
°С. X. бария Ва(С1O3)2 - кристаллы ромбич. сингонии
(пространств. группа Fdd2); т. пл. 400 °С (с разл.; плотн. 3,347
г/см3;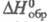 -738,0 кДж/моль; р-римость в воде при 25 °С 42,9 г в 100 г; моногидрат
обезвоживается выше 135 °С. AgClO3 -кристаллы тетрагон. сингонии
(пространств. группа I4/mmm), при 142 °С переходит в кубич.
форму; т. пл. 231 °С; плотн. 4,439 г/см3;
-738,0 кДж/моль; р-римость в воде при 25 °С 42,9 г в 100 г; моногидрат
обезвоживается выше 135 °С. AgClO3 -кристаллы тетрагон. сингонии
(пространств. группа I4/mmm), при 142 °С переходит в кубич.
форму; т. пл. 231 °С; плотн. 4,439 г/см3;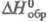 -25,5
кДж/моль; взрывает при нагревании, особенно после длит. хранения или пребывания
на свету.
-25,5
кДж/моль; взрывает при нагревании, особенно после длит. хранения или пребывания
на свету.
В пром-сти X. получают обменной р-цией
NaClO3 с хлоридами металлов.
Расходуют X. в целлюлозно-бумажной пром-сти
на получение С1O2 для отбеливания, на произ-во перхлоратов,
в качестве гербицидов и дефолиантов хлопчатника и др. культур [Са(С1О3)2,
Mg(ClO3)2], компонентов пиротехн. составов, окислителей
в смесевых ВВ, КС1О3 - в произ-ве спичек, NaClO3
- в пиротехн. источниках кислорода.
При попадании в организм X. действует
на кровь - переводят гемоглобин в метгемоглобин и вызывают распад эритроцитов.
Токсичная доза для человека менее 1 г на 1 кг массы, 10 г могут вызывать
смерть.
В. Я. Росоловский.


