ХИНОКСАЛИН, мол. м. 130,15; бесцв.
кристаллы; т. пл. 28 °С, т. кип. 220-223 °С, 108-111 оС/12 мм
рт. ст.; 1,69 х 10-30 Кл х м; сравнительно сильное основание (рКа0,51).
Хорошо раств. в воде и большинстве орг. р-рителей; с водой образует гидрат,
т. пл. 37 оС.
1,69 х 10-30 Кл х м; сравнительно сильное основание (рКа0,51).
Хорошо раств. в воде и большинстве орг. р-рителей; с водой образует гидрат,
т. пл. 37 оС.
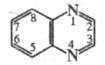
X.- -дефицитное
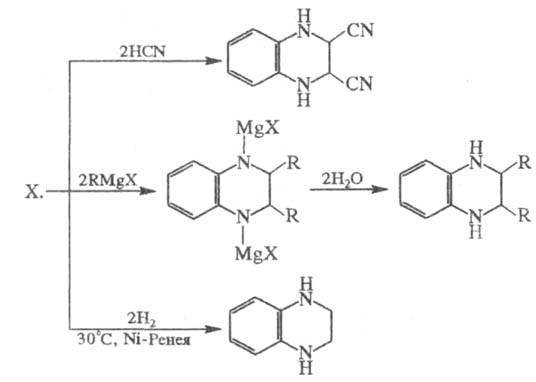
гетероароматич. соед. Легко вступает в р-ции нуклеоф. присоединения и восстановления,
напр.:
-дефицитное
гетероароматич. соед. Легко вступает в р-ции нуклеоф. присоединения и восстановления,
напр.:
Электроф. замещение протекает по бензольному
кольцу X. в жестких условиях, напр. нитрование смесью конц. HNO3
и олеума при 90 °С (в течение суток) приводит к образованию смеси 1,5%
5-нитро- и 24% 5,6-динитрохиноксалина.
X. инертен к окислению HNO3
и К2Сr2О7, однако окисление КМnО4
в щелочном р-ре сопровождается расщеплением бензольного кольца с образованием
2,3-пиразиндикарбоновой к-ты, окисление персульфатом аммония дает 2,3-дигидроксихиноксалин
(выход 30%).
X. легко превращается в N-оксиды, напр.
окисление 1 эквивалентом надуксусной к-ты приводит к 1-оксиду, избытком
к-ты - к 1,4-диоксиду. Дальнейшее восстановит. хлорирование моно- или ди-N-оксидов
X. действием РОС13 идет с образованием соотв. 2-хлор- и 2,3-дихлорпроизводных
X.
Получают X. конденсацией
о-фенилендиамина
с глиоксалем или его бисульфитным производным при 60 °С.
X. - структурный фрагмент нек-рых прир.
соед., напр. пептидного антибиотика эхиномицина. Нек-рые производные X.
обладают противовес палит., антибактериальной (напр., сульфахиноксалин),
анальгетич. и противомалярийной активностью.
Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 6, М., 1960, с. 373-403; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 160; Sakata G., Мakinо К., "Heterocycles", v. 27,1988, p. 2481.
P. А. Караханов, В. И. Келарев.


