ХИМОТРИПСИН, фермент класса гидролаз,
катализирующий гидролиз пептидных связей, удаленных от концов белковой
цепи (эндопептидаза). С наиб. скоростью катализирует гидролиз связей, образованных
карбоксильными группами гидрофобных аминокислот. Гидролизует также сложные
эфиры и амиды, образованные этими аминокислотами.
X.- фермент большинства позвоночных, синтезируется
в поджелудочной железе в форме неактивного предшественника (профермента,
или зимогена) химотрипсиногена, к-рый в двенадцатиперстной кишке под действием
трипсина подвергается протеолизу с образованием X.
Трипсин гидролизует в проферменте 4 пептидные
связи и удаляет из молекулы два дипептида в положениях 14-15 и 147-148.
Образовавшиеся три фрагмента молекулы X. остаются соединенными двумя дисульфидными
связями. X. вместе с трипсином участвует в расщеплении белков в тонком
кишечнике.
Секретируются две разные формы X.- А и
В, различающиеся по аминокислотному составу. Наиб. хорошо изучена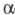 -модификация X. А быка (
-модификация X. А быка (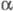 -X;
мол. м. 25 тыс.), образование к-рой из профермента идет через промежут.
модифицир. формы X. А
-X;
мол. м. 25 тыс.), образование к-рой из профермента идет через промежут.
модифицир. формы X. А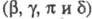 . В ферменте имеется 6 связей S — S; размеры молекулы близки к сферической
(5,5 х 3,5 х 3,8 нм). Макс. каталитич. активность
. В ферменте имеется 6 связей S — S; размеры молекулы близки к сферической
(5,5 х 3,5 х 3,8 нм). Макс. каталитич. активность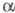 -X.
проявляется при рН 7,8-9,0; рI ок. 8.
-X.
проявляется при рН 7,8-9,0; рI ок. 8.
Для проявления каталитич. действия X.
наиб. существенны группы: гидроксильная серина-195 (принято, что нумерация
аминокислотных остатков в X. соответствует их положениям в проферменте),
имидазольная гистидина-57 и карбоксильная аспарагиновой к-ты-102 ("активная
триада"). Стабилизацию этой триады осуществляет ионная связь между a-аминогруппой
изолейцина-16 и карбоксильной группой аспарагиновой к-ты-194.
Сорбция субстрата в активном центре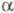 -X.
обеспечивается гидрофобной полостью. Ее размеры 1,0 х 0, 5 х 0,4 нм оптимальны
для связывания боковых цепей остатков гидрофобных аминокислот (триптофан,
фенилаланин, лейцин, тирозин), а конфигурация допускает лишь определенную
ориентацию субстрата. Механизм каталитич. гидролиза включает стадию сорбции
субстрата, расщепления пептидной связи с образованием ацилфермента и послед.
переноса ацильной группы на нуклеоф. акцептор.
-X.
обеспечивается гидрофобной полостью. Ее размеры 1,0 х 0, 5 х 0,4 нм оптимальны
для связывания боковых цепей остатков гидрофобных аминокислот (триптофан,
фенилаланин, лейцин, тирозин), а конфигурация допускает лишь определенную
ориентацию субстрата. Механизм каталитич. гидролиза включает стадию сорбции
субстрата, расщепления пептидной связи с образованием ацилфермента и послед.
переноса ацильной группы на нуклеоф. акцептор.
Ингибиторы X.- ионы тяжелых металлов,
борорг. к-ты, диизопропилфгорфосфат и др.
Недостаток или избыток X. проявляется
в нарушениях пищеварения. Фермент применяют в медицине для расщепления
некротизир. тканей, разжижения и облегчения выделения мокроты, при тромбофлебитах
и др.
Лит.: Березин И. В., Мартинек К., Основы физической химии ферментативного катализа, М., 1977, с. 126-70; Диксон М., Уэбб Э., Ферменты, пер. с англ., т. 1, М., 1982; Вlow D. М., в кн.: The Enzymes, 3 ed., ed. by P. D. Boyer, v. 3, N. Y.- L., 1971, p. 185-212.
Н. Ф. Казанская.


