ХИМИЧЕСКОЕ СРОДСТВО (сродство р-ции), параметр термодинамич. системы, характеризующий отклонение от состояния хим. равновесия. Если р-цию записать в виде ур-ния:
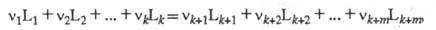
где L1, ..., Lk - исходные реагенты, Lk+1, ..., Lk+m - продукты р-ции, v1, ..., vk и vk+1 , ..., vk+m - стехиометрич. коэф., то X. с. А равно:
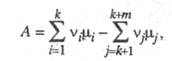
где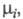
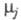 - хим. потенциалы соотв. исходных реагентов и продуктов. В состоянии равновесия
- хим. потенциалы соотв. исходных реагентов и продуктов. В состоянии равновесия
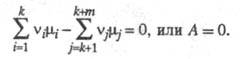
При A > 0 неравновесное состояние
системы характеризуется избытком исходных реагентов и для достижения равновесия
р-ция должна идти слева направо; при А < 0, наоборот, система
содержит избыток продуктов и р-ция должна идти в противоположном направлении.
X. с. равно макс. полезной работе р-ции, взятой со знаком минус. X. с.
определяет собственно хим. процесс, связанный лишь с изменением состава
системы и не связанный с работой по преодолению сил внеш. давления (см.
Максимальная работа реакции).
Единица измерения X. с.- Дж/моль.
Стандартное X. с. А0
определяется соотношением:
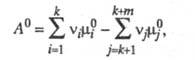
где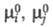 - стандартные хим. потенциалы соотв. реагентов и продуктов (см. Стандартное
состояние). Стандартное X. с. связано со стандартным изменением
энергии Гиббса
- стандартные хим. потенциалы соотв. реагентов и продуктов (см. Стандартное
состояние). Стандартное X. с. связано со стандартным изменением
энергии Гиббса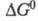 и константой равновесия р-ции К:
и константой равновесия р-ции К:
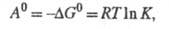
где Т - абс. т-ра; R - газовая
постоянная.
В хим. термодинамике X. с. рассматривается
в сочетании с хим. переменной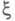 (наз. также степенью полноты р-ции, числом пробегов р-ции). Если в системе
изменение чисел молей компонентов dni происходит лишь
в результате хим. р-ции (закрытая система), то dni связаны
соотношением:
(наз. также степенью полноты р-ции, числом пробегов р-ции). Если в системе
изменение чисел молей компонентов dni происходит лишь
в результате хим. р-ции (закрытая система), то dni связаны
соотношением:
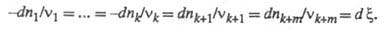
Интегрирование этого соотношения приводит к выражениям:
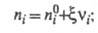
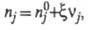
где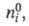
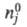 - соотв. числа молей исходных компонентов и продуктов в начальный момент
времени. Эти выражения являются определяющими для хим. переменной
- соотв. числа молей исходных компонентов и продуктов в начальный момент
времени. Эти выражения являются определяющими для хим. переменной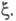 Энергия Гиббса системы
Энергия Гиббса системы
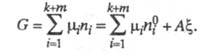
С помощью X. с. и хим. переменной можно провести термодинамич. описание закрытой системы, где обратимо протекает хим. р-ция, способом, отличным от традиционного описания Гиббса. Цель подобного описания - уменьшить число переменных ni, nj благодаря учету стехиометрии р-ции. Полные дифференциалы термодинамических потенциалов такой системы - внутр. энергии U, энтальпии H, энергии Гиббса G, свободной энергии Гельмгольца F - м. б. представлены в виде ф-л:
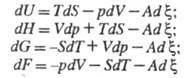
(S - энтропия системы; V - объем; р - давление). Отсюда следует:
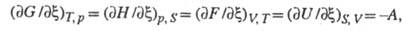
т. е. X. с. является производной любого
термодинамич. потенциала по хим. переменной при постоянстве естеств. переменных
каждого из потенциалов. В этих выражениях член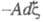 заменяет сумму
заменяет сумму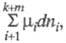 используемую при традиционном (Гиббсовом) описании. При этом вместо числа
переменных (k + т)достаточно одной независимой переменной
используемую при традиционном (Гиббсовом) описании. При этом вместо числа
переменных (k + т)достаточно одной независимой переменной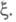 Если в системе протекает r независимых р-ций, для описания системы
нужно ввести r хим. переменных и r величин X. с. Л.
Если в системе протекает r независимых р-ций, для описания системы
нужно ввести r хим. переменных и r величин X. с. Л.
X. с. и хим. переменную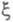 обычно относят к т. наз. внутренним параметрам макроскопич. системы. Это
означает, что, во-первых, А и
обычно относят к т. наз. внутренним параметрам макроскопич. системы. Это
означает, что, во-первых, А и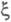 однозначно выражаются через параметры системы (хим. потенциалы, числа молей)
и стехиометрич. коэф. и, во-вторых, A и
однозначно выражаются через параметры системы (хим. потенциалы, числа молей)
и стехиометрич. коэф. и, во-вторых, A и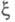 не характеризуют однозначно состояние термодинамич. равновесия (А =
0 для всех состояний равновесия). В термодинамике необратимых процессов
величина А/Т рассматривается как обобщенная термодинамич. сила,
а скорость хим. р-ции
не характеризуют однозначно состояние термодинамич. равновесия (А =
0 для всех состояний равновесия). В термодинамике необратимых процессов
величина А/Т рассматривается как обобщенная термодинамич. сила,
а скорость хим. р-ции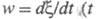 - время) - как обобщенный поток. Произведение (A/T)w обусловливает
произ-во энтропии в системе вследствие хим. реакции. Вблизи состояния термодинамич.
равновесия постулируется связь между w и А/Т типа:
- время) - как обобщенный поток. Произведение (A/T)w обусловливает
произ-во энтропии в системе вследствие хим. реакции. Вблизи состояния термодинамич.
равновесия постулируется связь между w и А/Т типа:
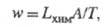
коэф. Lхим наз.
хим. проводимостью.
Понятие X. с. введено Т. де Донде в 1922.
Лит. см. при ст. Термодинамика необратимых процессов, Термодинамические потенциалы.
М. В. Коробов.


