ФТОРОФОСФАТЫ, соединения,
содержащие анионы гек-сафгорофосфорной HPF6, дифторофосфорной HPO2F2
и MO-нофторофосфорной H2PO3F к-т. Ф. щелочных, щел.-зем.
и др. двухвалентных металлов - типичные соли. Гексафторофос-фаты Li, Na и NH+4
хорошо раств. в воде, К - умеренно, Rb и Cs - плохо. Дифгорофосфаты и монофторофосфаты
щелочных металлов и аммония хорошо раств. в воде, Ф. щел.-зем. и др. двухвалентных
металлов - плохо. Дифторофосфаты щелочных металлов плавятся при 200-300 0C,
а монофторофосфаты - при 600-800 0C.
Гексафторофосфат-ион PF-6
в р-рах солей представляет собой правильный октаэдр. В кристаллич. солях
атомы фтора в PF-6 неэквивалентны. По данным рентгеноструктурного
анализа, длины связей 2 аксиальных атомов F с атомом P неск. увеличены по сравнению
со связями 4 экваториальных.
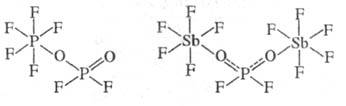
Анионы PO2F-2
и PO3F2-, в отличие от PF-6, могут
не только входить в состав солей, но и образовывать с к-тами Льюиса комплексные
соед., устойчивые в орг. р-рителях. Напр., в р-циях с PF5 и AsF5
анион PO2F-2 выступает в роли моноден-татного
лиганда, а с более сильной к-той, напр., SbF5,- в качестве мостиковой
группы:
Ф. получают взаимод. PF5
или PCl5 с фторидами металлов во фтористоводородной к-те или в орг.
р-рителях, а также сплавлением P2O5 или фосфатов с соответствующими
фторидами. Практич. значение имеют монофторофосфаты как компоненты спец. стекол
и зубных паст и гексафторофосфаты как компоненты электролитов хим. источников
тока.
Лит.: Буслаев Ю.А.,
Ильин E. Г., в кн.: Итога науки и техники, сер. Неорганическая химия, т. 10,
M., 1987. Е.Г.- Ильин.


