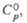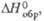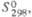ФТОРОСИЛИКАТЫ, соединения,
содержащие анионы 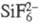 (гексафторосиликаты) или
(гексафторосиликаты) или 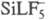 (пентафторосиликаты; L = H2O, NH3, RNH2, R2NH
и др.). К Ф. (табл.) относятся также соед., содержащие одновременно анионы
(пентафторосиликаты; L = H2O, NH3, RNH2, R2NH
и др.). К Ф. (табл.) относятся также соед., содержащие одновременно анионы 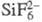 и F- (геп-тафторосиликаты),
и F- (геп-тафторосиликаты), 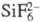 и SiF-5, (ундекафгородисиликаты и гексадекафторотрисиликаты).
Наиб. значение имеют гексафторосиликаты - соли кремне фтористоводородной
кислоты, к-рые известны для одно- и двухзарядных ионов металлов, однозарядных
ионов типа
и SiF-5, (ундекафгородисиликаты и гексадекафторотрисиликаты).
Наиб. значение имеют гексафторосиликаты - соли кремне фтористоводородной
кислоты, к-рые известны для одно- и двухзарядных ионов металлов, однозарядных
ионов типа 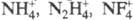 , а также нек-рых трехзарядных ионов. Могут содержать смешанные катионы, напр.
NaKSiF6, KRbSiF6. Твердая кремнефтористо-водородная к-та
- гексафторосиликат оксония (H5O2)2SiF6.
Гексафторосиликаты двухзарядных металлов образуют ди-, тетра- или гексагидраты.
, а также нек-рых трехзарядных ионов. Могут содержать смешанные катионы, напр.
NaKSiF6, KRbSiF6. Твердая кремнефтористо-водородная к-та
- гексафторосиликат оксония (H5O2)2SiF6.
Гексафторосиликаты двухзарядных металлов образуют ди-, тетра- или гексагидраты.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ
ФТОРОСИЛИКАТОВ
|
Соединение |
Сингония |
Параметры элементарной
ячейки |
Число фор-мульных
единиц в ячейке |
T. пл., 0C |
Т-ра полиморфного
перехода, :С |
Дж/(моль· К) |
кДж/моль |
Дж/(моль· К) |
|||||
|
а, нм |
b, нм |
с, нм |
угол, град |
||||||||||
|
Na2SiF6 |
Гексагон. |
— |
— |
— |
— |
— |
840 |
040 |
— |
-2913 |
_ |
||
|
K2SiF6 |
Кубич. |
0,8184 |
— |
— |
— |
4 |
873 |
— |
219,0 |
-2940 |
— |
||
|
K4SiF7 |
Тетрагон. |
0,7721 |
— |
0,5505 |
— |
— |
Разлагается |
— |
— |
— |
— |
||
|
MgSiF6·
6H2O |
Моноклинная |
0,040 |
0,9524 |
0,840 |
99,04 |
2 |
" |
25 |
431 |
-4579 |
415,0 |
||
|
BaSiF6 |
Гексагон. |
0,7108 |
— |
0,0995 |
— |
3 |
" |
— |
— |
-2937 |
— |
||
|
CuSiF6·
6H2O |
" |
1,813 |
— |
0,9787 |
— |
12 |
" |
23 |
— |
— |
— |
||
|
MnSiF6·
6H2O |
" |
0,970 |
— |
0,980 |
— |
3 |
" |
-37 |
455,3 |
— |
453,2 |
||
|
FeSiF6·
6H2O |
Тритон. |
0,042 |
— |
— |
90,98 |
1 |
" |
-49 |
447,9 |
— |
— |
||
|
CoSiF6·
6H2O |
" |
0,027 |
— |
— |
90,02 |
1 |
" |
-8,3 |
440,0 |
— |
— |
||
|
NiSiF6·
6H2O |
Гексагон. |
0,8298 |
— |
0,8523 |
— |
3 |
" |
— |
428,1 |
— |
415,2 |
||
Общее св-во безводных Ф.-
способность к термич. разложению до простых фторидов при сравнительно невысоких
т-рах. В р-рах Ф. подвергаются щелочному гидролизу с образованием гидратированного
SiO2 или силикатов и фторидов металлов. При взаимод. с сильными конц.
к-тами Ф. разлагаются с выделением HF и SiF4. Выше 500-600 0C
Ф. подвергаются пирогидролизу. Осн. способы получения Ф.-осаждение из р-ров
кремнефтористоводородной к-ты действием солей металлов или обменными р-циями
в р-рах.
Гексафторосиликат натрия
Na2SiF6 разлагается ок. 570 0C, хорошо раств.
в воде (7,62 г/л при 25 0C); в природе - редкий минерал маллордит;
применяют для получения NaF, Na3AlF6, K2SiF6,
NH4F и CaF2, как компонент флюсов для сварки и пайки металлов,
эмалей, р-ров для травления стекла, флотореагент, реагент для фторирования воды
и концентратов Be, для получения Si электроосаждением из фгоридных расплавов
или алюминотермией.
Гексафторосиликат калия
K2SiF6разлагается ок. 700 0C с образованием
на промежут. стадии K3SiF7, плохо раств. в воде (0,12%
по массе при 20 0C); в природе - редкий минерал гиератит; применяют
как реагент для фторирования цирконовых концентратов и электроосаждения Si из
фгоридных расплавов, компонент смесей для получения синтетич. слюд, эмалей и
кислотостойких замазок.
Разл. Ф. используют как
консерванты древесины (Ф. натрия, К, Mg, Ba, Zn, Cu), компоненты бетона (Ф.
натрия, К, Mg, Ba, Zn), р-ров для рафинирования цветных металлов (Ф. меди, Pb,
Со и др.).
См. также Аммония гексафторосиликат.
Э. Г. Раков. ФТОРОТАН (2-бром-1,1,1-трифтор-2-хлорэтан) F3CCHClBr,
мол. м. 197,39; бесцв. прозрачная подвижная легко летучая жидкость со жгучим
сладковатым запахом и вкусом; т. кип. 50,2 0C, плотн. 1,872 г/см3
(для фармакопейного препарата соотв. 49-51 0C и 1,865-1,870 г/см3),
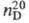 1,3691,
давление пара при 20 0C 3,22·104 Па; плохо раств. в воде
(0,345%), смешивается с орг. р-рителями и маслами. Растворяет резину, в присут.
воды реагирует со мн. металлами. Для предотвращения разложения под действием
света к Ф. добавляют 0,01% тимола и хранят препарат в сосудах из оранжевого
стекла. Получают Ф. по схеме:
1,3691,
давление пара при 20 0C 3,22·104 Па; плохо раств. в воде
(0,345%), смешивается с орг. р-рителями и маслами. Растворяет резину, в присут.
воды реагирует со мн. металлами. Для предотвращения разложения под действием
света к Ф. добавляют 0,01% тимола и хранят препарат в сосудах из оранжевого
стекла. Получают Ф. по схеме:
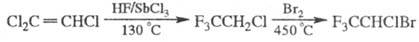
Ф. применяют как ср-во для ингаляционного наркоза. Он легко всасывается и быстро выводится из организма. Негорюч, невзрывоопасен, не раздражает слизистые оболочки и слабо влияет на функцию почек (т.к. гидролитически устойчив; метаболиты - трифторуксусная к-та, Br-, Сl-). Л.Н. Койков.