ФТОР (отгреч. phthoros
- разрушение; лат. Fluorum) F, хим. элементVП гр. периодич. системы, относится
к галогенам; ат. н. 9, ат. м. 18,998403. Прир. Ф. состоит из одного стабильного
нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1 ·10-31
м2. Конфигурация внеш. электронной оболочки атома 2s22p5
степень окисления -1; энергии ионизации при последоват. переходе от F0
к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868
кДж/моль; сродство к электрону 327,8 кДж/моль. Ф.- самый электроотрицат. элемент,
его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны
координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6).
Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия
гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением.
Молекула своб. Ф. двухатомна,
межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению
с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль).
Содержание Ф. в земной
коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал,
имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения
к-рого встречаются на всех континентах, а наиб. запасы сосредоточены в США,
Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание
Ф. в пром. рудах CaF2 122, в перспективных - 236 млн. т (1984, без
СССР). В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане,
в Забайкалье, Приморском крае и др.
К редким фторсодержащим
минералам относятся криолит Na3AlF6, хиолит 5NaF·3AlF3,
селлаит MgF2, иттрофлюорит Ca1-xYxF2-x.
Изоморфно замещая ионы ОН-, О2- и др., Ф. входит также
в состав мн. минералов, напр. топаза Al2SiO4(OH, F)2,
амблигонита LiAlPO4(OH, F), бастнезита (Ce, La)CO3F, апатита
Ca5(PO4)3(OH, F), слюд и гидросиликатов. Наиб.
пром. значение помимо флюоритовых руд имеют апатит и фосфориты, из к-рых Ф.
получают в виде хим. соед.; они содержат не более 3,5-4,2% Ф. по массе, но добываются
в больших кол-вах для произ-ва соед. фосфора. Запасы Ф. в фосфатных рудах СНГ
в 5 раз превышают его запасы во флюоритовых рудах (1988). Соед. Ф. содержатся
во мн. подземных водах.
В небольших кол-вах Ф.
входит в состав живых организмов (в организме человека 2,6 г Ф., из них 2,5
г - в костях), участвует в процессах образования зубов и костей, в обмене в-в
и в активации нек-рых ферментов. Нормальное поступление Ф. в организм человека
2,5-3,5 мг в сут. Пониженные и повышенные кол-ва Ф. вызывают разл. заболевания.
Свойства. Ф.- бесцв. газ
с сильным запахом, напоминающим запах хлора; т. кип. -188,20 0C,
т. пл. -219,70 0C; плотн. газа 1,693 кг/м3 (О 0C,
0,1 МПа), жидкости 1516 кг/м3 (-188 0C); .tкрит
-128,84 0C, pкрит 5,215 МПа, dкрит
0,574 г/см3; давление в тройной точке 252 Па; 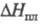 0,5104 кДж/моль,
0,5104 кДж/моль,  6,544 кДж/моль; C0p 31,34 Дж/(моль·К);
6,544 кДж/моль; C0p 31,34 Дж/(моль·К); 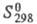 202,68 Дж/(моль· К); теплопроводность газообразного Ф. с точностью до 10% совпадает
с теплопроводностью N2; коэф. самодиффузии при 0 0C и
атм. давлении 0,170 см2/с.
202,68 Дж/(моль· К); теплопроводность газообразного Ф. с точностью до 10% совпадает
с теплопроводностью N2; коэф. самодиффузии при 0 0C и
атм. давлении 0,170 см2/с.
В твердом состоянии при
обычном давлении Ф. образует две кристаллич. модификации: ниже -227,60 0C
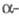 форму
с моноклинной решеткой (плотн. 1,97 г/см3 при -250 С), выше -
форму
с моноклинной решеткой (плотн. 1,97 г/см3 при -250 С), выше - 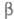 -форму
с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
-форму
с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
Плотн. жидкого Ф. описывается
ур-нием d= 1,907-2,20- 10-3T-2,948·10-5T2
г/см3 (67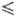 T
T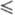 103 К); вязкость - ур-нием
103 К); вязкость - ур-нием 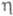 =
2,43 · 10-7ехр( 196/T)Па ·с; ур-ние температурной зависимости
давления пара над жидким Ф. 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2
- 1,34590196X3 + + 2,71138936X(1-X)1,4327,
где X = (1 - Ттр/T)/(1 - Ттр/Ткрит;
Tтр и pтр - соотв. т-ра и давление в
тройной точке; Ткрит -критич. т-ра; g жидкого
Ф. 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К);
=
2,43 · 10-7ехр( 196/T)Па ·с; ур-ние температурной зависимости
давления пара над жидким Ф. 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2
- 1,34590196X3 + + 2,71138936X(1-X)1,4327,
где X = (1 - Ттр/T)/(1 - Ттр/Ткрит;
Tтр и pтр - соотв. т-ра и давление в
тройной точке; Ткрит -критич. т-ра; g жидкого
Ф. 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К); 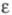 1,4577 (70,0 К) и 1,2073 (143,0 К).
1,4577 (70,0 К) и 1,2073 (143,0 К).
Ф. раств. в нек-рых фторидах,
хлор- и фторуглеродах. Жидкий Ф. неограниченно смешивается с жидкими O2
и O3. С водой энергично реагирует: 2F2 + 2H2O 4HF + O2. Не образует кислородных к-т, с H2 бурно реагирует,
давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
4HF + O2. Не образует кислородных к-т, с H2 бурно реагирует,
давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
Ф.- один из сильнейших
окислителей и фторирующих реагентов. Благодаря высокой энергии связи элемент
— фтор во фторидах и низкой энергии диссоциации F2 многие р-ции фгорирования
простых в-в, оксидов, галогенидов и др. соед. необратимы, сопровождаются выделением
большого кол-ва тепла и образованием фторидов элементов в высш. степенях окисления.
Все хим. элементы, за исключением Не, Ne и Ar, образуют устойчивые фториды.
В то же время по кинетике
взаимод. с Ф. поведение в-в может сильно отличаться. Многие р-ции имеют цепной
характер, самопроизвольно инициируются при комнатной или более низкой т-ре и
протекают со вспышкой или со взрывом, а в потоке - с возникновением пламени.
К таким р-циям относится фторирование H2 и водородсодержащих в-в
(углеводородов, H2O, NH3, N2H4,
HCl, HBr, HCN и др.), S и ее производных (SO2, SOCl2,
S4N4, SBr2 и др.), Si, P и др. Теоретич. т-ра
горения стехиометрич. смеси с H2 4430 К. При комнатной т-ре с Ф.
способны реагировать щелочные металлы, нек-рые галогениды, гидраты солей. В
то же время р-ции F2 с большей частью простых в-в и неорг. соед.
протекают лишь при их активации, достигаемой обычно повышением т-ры или давления.
На величину т-ры начала фгорирования влияют природа в-в, дисперсность твердых
в-в, св-ва продуктов р-ции (нелетучие фториды могут экранировать пов-сть, замедлять
и даже прекращать фторирование), условия процесса (парциальное давление F2,
интенсивность теплоотвода и др.). Р-ция F2 с Ag, V, Re, Os начинается
при 100-250 0C, с Au, Cd, Ti, Zr, Nb, Та, Cr, W, Mn, Со - при 300-350
0C, а с Al, Fe, Cu, Zn, Y, Ni (на пов-сти к-рых образуется пленка
нелетучих фторидов) - лишь ок. 400-500 0C. Температурный интервал
"спокойного", регулируемого фгорирования, однако, невелик, и при
избытке F2 многие р-ции переходят при превышении нек-рой т-ры в горение.
Особое место занимает фгорирование графита, сопровождающееся образованием при
т-рах ниже 400 0C фторидов графита CFx (см. Графита
соединения).
Оксиды металлов и многие
соли неск. более устойчивы к действию F2, чем сами металлы. Взаимод.
оксидов может сопровождаться образованием на промежут. стадиях окси-фторидов.
Наиб. устойчивы к действию
F2 благородные газы, N2, O2, алмаз, нек-рые
виды стеклоуглерода, СО, CO2, сапфир и алунд.
Одним из путей снижения
т-ры фгорирования является применение катализаторов. Активация F2
м. б. проведена также его атомизацией и ионизацией в газовых разрядах, электронном
пучке, под действием УФ облучения и термока-талитически (на нагретой пов-сти
катализатора). Атомный F при комнатной т-ре и в криогенных условиях взаимод.
с Xe,
Kr, СО, NOF, NO2,
O2, ClF3 и мн. др. в-вами. См. также Фторирование.
Наиб. важным соед. Ф. посвящены
отдельные статьи: Азота фториды, Бора трифторид, Галогенфториды, Кислорода
фториды, Кремния фториды, Фтористоводородная кислота, Фтористый водород, Фторобораты,
Фторорганические соединения, Фторосиликаты и др.
Получение. Общая
схема произ-ва своб. Ф. включает добычу и обогащение флюоритовых руд, серно-кислотное
разложение флюоритовых концентратов, выделение и очистку безводного HF, его
электролитич. разложение. Ведущие производители флюоритовых концентратов - Мексика
(20-25% мирового произ-ва), ЮАР, Монголия, КНР, Таиланд, Франция, Испания. Общий
мировой объем их произ-ва 4-5 млн. т в год.
Электролитич. разложение
HF м. б. осуществлено 3 способами: низкотемпературным (15-50 0C,
в смеси HF с KF), среднетемпературным (70-120 0C, расплав KH2F3)
и высокотемпературным (245-310 0C, расплав KHF2). В пром-сти
используют среднетемпературный способ. Стандартный потенциал разложения HF в
расплаве KH2F3 равен 2,9 В. Пром. электролизеры работают
обычно при 80-105 0C, напряжении 8,5-12,0 В и анодной плотности тока
70-180 мА/см2. Их мощность по току достигает 11 кА, опытных образцов
-15 кА, что соответствует производительности 7-10 кг Р2/ч.
Электролизеры представляют
собой стальные или монеле-вые ванны с размещенными на крышке угольными анодами
и расположенными между анодами стальными катодами. В нек-рых конструкциях между
катодами и анодами имеются перфорированные диафрагмы, предотвращающие смешивание
и взаимод. выделяющихся F2 и H2. Совр. электролизеры снабжены
системами непрерывной подачи в них HF, поддержания постоянной т-ры, отвода H2
и F2. Отбор F2 проводят с помощью спец. коробчатых сборников,
"колоколов", расположенных на крышке и погруженных в расплав так,
что они окружают верх. часть анодов. При электролизе на пов-сти угольных анодов
образуется пассивирующий слой фторидов графита CFx, что вызывает
"анодный эффект" - резкое повышение напряжения и его скачки. Этот
эффект подавляют введением в электролит добавок, использованием анодов особой
конструкции и пульсирующего тока. Свежезагружаемый электролит тщательно обезвоживают,
проводя электролиз примеси влаги при низком напряжении. Для снижения т-ры процесса
разрабатывают электролиз смеси KH2F3 - NH4HF2
- HF.
Очищают Ф. методами селективной
сорбции примесей (HF на гранулированном пористом NaF), вымораживания примесей,
сжижения Ф., хим. и фотохим. связывания примесей. Глубокую очистку Ф. проводят
с помощью низкотемпературной ректификации или его обратимой хемосорбцией (напр.,
путем образования и термич. разложения K2NiF4).
Для получения своб. Ф.
в лабораториях или в портативных установках могут использоваться его твердые
источники. Так, MnF4 при нагр. до 200 0C выделяет ок.
15% F2 от своей начальной массы. Взаимод. K2MnF6
и SbF5 протекает с выделением KSbF6, MnF3 и
F2. Разработаны пиротехн. источники F2, содержащие соли
тетрафтораммония.
Определение. Осн.
метод определения Ф. в р-рах - потен-циометрия с использованием спец. селективных
электродов. Чувствит. элемент таких электродов (мембрану) чаще всего изготовляют
из монокристаллич. LaF3, легированного дифто-ридами др. металлов.
Кроме того, применяют гравиметрич. или объемный методы, основанные на осаждении
труднорастворимых PbClF, CaF2, ThF4 и др.
Наиб, универсальный метод
разложения мн. твердых неорг. фторидов - пирогидролиз. Образующийся HF
поглощают водными р-рами и анализируют объемным или потенциометрич. методами.
Применяют также отгонку с парами H2O и улавливание в виде H2SiF6,
разл. физ. методы.
Свободный Ф. в газах определяют
потенциометрически, поглощением его твердым NaCl и последующим определением
выделившегося Cl2 иодометрически, поглощением его ртутью и волюмометрич.
определением. Фторорг. в-ва предварительно
разлагают натрием. Качественно Ф. обнаруживают по вьщелению HF, а также методами
количеств, анализа.
Применение. Своб.
Ф- фторирующий реагент в произ-ве UF6 (см. Урана фториды), галогенфторидов,
SF4, SF6, BF3, фторидов азота, фторидов графита,
высш. фторидов металлов (WF6, MoF6, ReF6),
фторидов благородных газов, фторорг. производных и др. Атомный Ф. используют
в хим. лазерах на HF и DF, для синтеза KrF2, кислорода фторидов
и др.
Ф. сильно токсичен. Раздражает
кожу, слизистые оболочки носа и глаз; непереносимая концентрация 77 мг/м3.
Вызывает дерматиты, конъюнктивиты, отек легких. Контакт с чистым Ф. приводит
к ожогу. Хронич. отравление соед. Ф. вызывает флюороз. ПДК 0,03 мг/м3
- в воздухе производств. помещений, 0,7 мг/л - в воде (для фторид-иона).
Сжиженный Ф. перевозят
в охлаждаемых цистернах и хранят в танках.
Мощности по произ-ву своб.
Ф. в развитых странах достигают 15-20 тыс. т в год.
Ф. открыт К. Шееле в 1771,
в свободном виде получен А. Муассаном в 1886.
Лит.: Раков Э.Г.,
Химия и технологах неорганических фторидов, M., 1990; Gmelins handbook of inorganic
chemistry, system. № 5. F. Fluorine. Suppl. v. 2. The element, B., 1980. Э.Г.
Раков.


