ФОТОХРОМИЗМ, индуцированное
светом обратимое превращение в-ва А (фотохрома) в продукт В, отличающийся спектром
поглощения (окраской) и внутр. энергией. Если В -электронно-возбужденное состояние
А , говорят о физическом Ф., если же В - форма, изомерная А в основном электронном
состоянии, то это - химический Ф. Большой запас внутр. энергии у в-ва В является
движущей силой обратного перехода 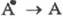 или
или 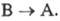
Фотохррмные системы характеризуют
спектрами поглощения А и В (или А*), квантовым выходом перехода 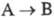 т. наз. светочувствительностью f, временем темновой релаксации
т. наз. светочувствительностью f, временем темновой релаксации 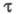 (самопроизвольного перехода
(самопроизвольного перехода 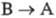 в отсутствие освещения), квантовым выходом фоторазложения
в отсутствие освещения), квантовым выходом фоторазложения 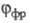 из-за участия А, А*, В в необратимых хим. р-циях.
из-за участия А, А*, В в необратимых хим. р-циях.
Физический фотохромизм.
Окрашивание в-ва или его обесцвечивание обусловлено квантовыми переходами
между возбужденными состояниями молекул. Среда (матрица) влияет на время темновой
релаксации вследствие тушения возбужденных состояний: в жидких средах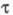 сильно
уменьшается из-за высокой скорости диффузии, в твердых телах значение
сильно
уменьшается из-за высокой скорости диффузии, в твердых телах значение 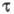 определяется внутримол. процессами перераспределения энергии между разл. видами
возбуждения. Для первого синг-летного возбужденного состояния S1
время
определяется внутримол. процессами перераспределения энергии между разл. видами
возбуждения. Для первого синг-летного возбужденного состояния S1
время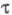 составляет
10-6 -10-10 с, для триплетного возбужденного состояния
T время
составляет
10-6 -10-10 с, для триплетного возбужденного состояния
T время 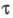 принимает значения от 10-5 до 10 с. Для наблюдения фотохромного
эффекта на уровне S1 требуется интенсивность облучения
102 - 105 Э/(м2·с), 1 Э (эйнштейн) = 6,02·
1023 фотонов. Для фотохромного эффекта на уровнях T необходимы
интенсивности на 5 порядков меньше. Поэтому практич. применение находят в осн.
системы с триплет-триплетными переходами (T-T-поглощение, или Т-Т-переходы).
Светочувствительность Т-Т-фотохромов определяется соотношением коэффициентов
T-T-поглощения на длинах волн возбуждения и активации, квантовыми выходами
образования триплетных состояний и их дезактивации под действием света. Для
повышения светочувствительности спектры Т-Т-поглощения не должны перекрываться
со спектрами синглет-синглетного поглощения. У известных Т-Т-фотохромов
переходы
принимает значения от 10-5 до 10 с. Для наблюдения фотохромного
эффекта на уровне S1 требуется интенсивность облучения
102 - 105 Э/(м2·с), 1 Э (эйнштейн) = 6,02·
1023 фотонов. Для фотохромного эффекта на уровнях T необходимы
интенсивности на 5 порядков меньше. Поэтому практич. применение находят в осн.
системы с триплет-триплетными переходами (T-T-поглощение, или Т-Т-переходы).
Светочувствительность Т-Т-фотохромов определяется соотношением коэффициентов
T-T-поглощения на длинах волн возбуждения и активации, квантовыми выходами
образования триплетных состояний и их дезактивации под действием света. Для
повышения светочувствительности спектры Т-Т-поглощения не должны перекрываться
со спектрами синглет-синглетного поглощения. У известных Т-Т-фотохромов
переходы  лежат в области 300-450 нм, а переходы T1-Tn
- при 300-700 нм. Наиб. важные физ. фотохромы - конденсированные полициклич.
ароматич. углеводороды, нек-рые гете-роциклы и их замещенные.
лежат в области 300-450 нм, а переходы T1-Tn
- при 300-700 нм. Наиб. важные физ. фотохромы - конденсированные полициклич.
ароматич. углеводороды, нек-рые гете-роциклы и их замещенные.
Химический фотохромизм
основан на изомеризации (обычно цис-транс-изомеризации), таутомерных
переходах, разрывах и образовании новых хим. связей, перициклич. внутри- и межмол.
превращениях; известны моно- и бимол. фотохромные процессы. Кроме спектров поглощения
и испускания, у хим. фотохромов могут изменяться показатель преломления, диэлектрич.
проницаемость, растворимость, вязкость, электрич. проводимость, фотопроводимость
и др. св-ва, что определяет многообразие их практич. применения.
У фотохромных 1,2-диарилзамещенных
олефинов, азосое-динений, азометинов цис-изомер поглощает в более коротковолновой
области (на 10-30 нм), чем транс-изомер. цис-транс-Изомеризация
проходит через возбужденные Т1состояния, к-рые имеют минимум
энергии при угле поворота связи ~ 90 °; цис-T1 и транс-T1
состояния переходят в общий Т1-уровень ("фантом-триплет"),
из него идет дезактивация в основные состояния цис-S0 и
транс-S0. T. к. уровень цис-Т1
лежит выше по энергии, чем уровень транс-Т1 то
квантовый выход транс-цис-изомеризации зависит от т-ры, тогда как квантовый
выход цис-транс-изомеризации от т-ры не зависит, т. е. переход цис-T1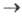 транс-Т1 экзотермичен. В стационарном состоянии при прямом
(без сенсибилизаторов) фотохромном процессе отношение концентраций цис- и
транс-изомеров определяется отношением произведения коэф. поглощения
транс-изомера при длине волны облучения на квантовый выход транс
транс-Т1 экзотермичен. В стационарном состоянии при прямом
(без сенсибилизаторов) фотохромном процессе отношение концентраций цис- и
транс-изомеров определяется отношением произведения коэф. поглощения
транс-изомера при длине волны облучения на квантовый выход транс цис
перехода к соответствующему произведению для цис-изомера
цис
перехода к соответствующему произведению для цис-изомера 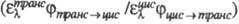 . При сенсибилизир. Ф. в систему вводят в-во с энергией возбужденного состояния
большей, чем у транс- и цис-изомеров. В этом случае в стационарном
состоянии отношение концентраций транс- и цис-изомеров не зависит
от козф. поглощения и определяется отношением констант скорости процессов перехода
в основное состояние транс-
. При сенсибилизир. Ф. в систему вводят в-во с энергией возбужденного состояния
большей, чем у транс- и цис-изомеров. В этом случае в стационарном
состоянии отношение концентраций транс- и цис-изомеров не зависит
от козф. поглощения и определяется отношением констант скорости процессов перехода
в основное состояние транс-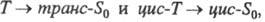 при этом квантовые выходы связаны соотношением:
при этом квантовые выходы связаны соотношением:
jцис ->
транс + j транс->цис = j s1-->T1
Тиоиндигоиды и др. олефины
с циклич. заместителями отличаются большим смещением поглощения цис-изомера
в коротковолновую область (до 150 нм), высоким уровнем поглощения e макс(~ 5 · 104), большими квантовыми выходами переходов транс
—> цис и цис -> транс. Главное преимущество тиоиндигоидов
как фотохромных систем - их способность к очень большому числу циклов изомеризации
(ок. 20000), что связано с крайне низким квантовым выходом фоторазложения.
Ф. наблюдается у большого
числа таутомерных систем, для к-рых фототаутомерия м. б. записана в виде схемы:
Z-X-C1=С2-С3=Y——>X
= C1-C2 = C3-Y-Z
Прототропная фототаутомерия
(Z = H) типична для о-алкил-арилкарбонильных соед. (X = С, Y = О), салициланилидов
(X = О, Y = NR), о-гидроксиароматич. соед. (X = О, Y = Ar) и др., напр.:
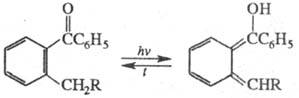
Если глубокоокрашенная
форма имеет хиноидное строение, она быстро термо- или фотоизомеризуется обратно.
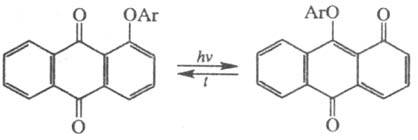
У арилоксихинонов (X = Y = O, С1, С2, С3- части
ароматич. или гетероароматич. ядер, Z = Ar) при фотолизе происходит термообратимая
фотохромная миграция арила:
В ряду бензотиофеновых
производных известна фотоаци-лотропия (X = О, Y = N, Z = Ac). Перемещения Z
происходят чаще всего внутримолекулярно, через трудно идентифицируемые переходные
состояния. Первичные продукты могут ионизироваться, образуя окрашенные мезомерные
ионы; это характерно, в частности, для нитроарил(гетарил)алканов.
Изучены фото-, термо- и
сольватохромные спиропираны, содержащие 1 или 2 пирановых ядра и получаемые
на основе разл. гетероциклов, производных салицилового альдегида, их аналогов
и замещенных (см. Спиросоединения). Их достоинства: простота синтеза,
отсутствие окраски у циклич. формы и интенсивный, часто глубокий цвет у мероцианиновой
формы. При больших смещениях поглощения в коротковолновую область и высоких
коэф. экстинкции эти в-ва часто отличаются большими квантовыми выходами фоторазложения,
что сужает области их применения.
Аналогично спиропиранам
обратимое раскрытие гетеро-цикла наблюдается у фотохромных хроменов, тиохроменов,
селенохроменов, дигидрохинолинов. Окрашенная орто-хи-ноидная форма стабилизируется
при аннелировании ароматич. цикла. Реакционноспособными у разл. соед. могут
быть S1 - и T1состояния.
К бимол. Ф. относятся,
напр., р-ции фотодимеризации полициклич. ароматич. соед. по мезо-положениям,
стильбе-нов и их гетероаналогов, проявляющиеся как резкий гипсо-хромный сдвиг
спектра поглощения.
Фотохромные системы используются
как светофильтры, светозащитные устройства, актинометры, дозиметры, для создания
рельефных и плоскостных изображений, аккумуляции солнечной энергии; на их основе
созданы устройства для хранения информации.
Лит.: Барачевский
В.А., Дашков Г.И., Цехомский В.А., Фотохромизм и его применение, M., 1977; Фотохимические
процессы в слоях, под ред. А.В. Ельцова, Л., 1978; Органические фотохромы, под
ред. А.В. Ельцова, Л., 1982; Photochromism: molecules and systems, eds. H. Durr,
Т.Н. Bouas-Lauren, Amst., 1990. A.B. Ельцов.


