ФОТОСИНТЕЗ, образование
зелеными растениями и нек-рыми бактериями орг. в-в с использованием энергии
солнечного света. Происходит при участии пигментов (у растений хлорофиллов).
В основе Ф. лежат окислит.-восстановит. р-ции, в к-рых электроны переносятся
от донора (напр., H2O, H2S) к акцептору (CO2)
с образованием восстановленных соед. (углеводов) и выделением O2
(если донор электронов H2O), S (если донор электронов, напр., H2S)
и др.
Ф.- один из самых распространенных
процессов на Земле, обусловливает круговорот в природе углерода, O2
и др. элементов. Он составляет материальную и энергетич. основу всего живого
на планете. Ежегодно в результате Ф. в виде орг. в-ва связывается ок. 8·1010
т углерода, образуется до 1011 т целлюлозы. Благодаря Ф. растения
суши образуют ок. 1,8·1011 т сухой биомассы в год; примерно такое
же кол-во биомассы растений образуется ежегодно в Мировом океане. Тропич. лес
вносит до 29% в общую продукцию Ф. суши, а вклад лесов всех типов составляет
68%. Ф. высших растений и водорослей - единственный источник атм. O2.
Возникновение на Земле
ок. 2,8 млрд. лет назад механизма окисления воды с образованием O2
представляет собой важнейшее событие в биол. эволюции, сделавшее свет Солнца
главным источником-своб. энергии биосферы, а воду - практически неограниченным
источником водорода для синтеза в-в в живых организмах. В результате образовалась
атмосфера совр. состава, O2 стал доступным для окисления пищи (см.
Дыхание), а это обусловило возникновение высокоорганизов. гетеротрофных
организмов (применяют в качестве источника углерода экзогенные орг. в-ва).
Ок. 7% орг. продуктов Ф.
человек использует в пищу, в качестве корма для животных, а также в виде топлива
и строит. материала. Ископаемое топливо - тоже продукт Ф. Его потребление в
кон. 20 в. примерно равно приросту биомассы.
Общее запасание энергии
солнечного излучения в виде продуктов Ф. составляет ок. 1,6 · 1021
кДж в год, что примерно в 10 раз превышает совр. энергетич. потребление человечества.
Примерно половина энергии солнечного излучения приходится на видимую область
спектра (длина волны l от 400 до 700 нм), к-рая используется для Ф. (физиологически
активная радиация, или ФАР). ИК излучение не пригодно для Ф. кислородвыделяющих
организмов (высших растений и водорослей), но используется нек-рыми фотосинтезирующи-ми
бактериями.
В связи с тем, что углеводы
составляют осн. массу продуктов биосинтетич. деятельности растений, хим. ур-ние
Ф. обычно записывают в виде:
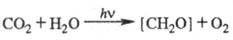
Для этой р-ции  469,3 кДж/моль, понижение энтропии 30,3 Дж/(К·моль),
469,3 кДж/моль, понижение энтропии 30,3 Дж/(К·моль),  -479 кДж/моль. Квантовый расход Ф. для одноклеточных водорослей в лаб. условиях
составляет 8-12 квантов на молекулу CO2. Утилизация при Ф. энергии
солнечного излучения, достигающего земной пов-сти, составляет не более 0,1%
всей ФАР. Наиб. продуктивные растения (напр., сахарный тростник) в среднем за
год усваивают ок. 2% энергии падающего излучения, а зерновые культуры - до 1%.
Обычно суммарная продуктивность Ф. ограничена содержанием CO2 в атмосфере
(0,03-0,04% по объему), интенсивностью света и т-рой. Зрелые листья шпината
в атмосфере нормального состава при 25 0C на свету насыщающей интенсивности
(при солнечном освещении) дают неск. литров O2 в час на грамм хлорофилла
или на килограмм сухого веса. Для водорослей Chlorella pyrenoidosa при 35 0C
повышение концентрации CO2 от 0,03 до 3% позволяет повысить выход
O2 в 5 раз, такая активация является предельной.
-479 кДж/моль. Квантовый расход Ф. для одноклеточных водорослей в лаб. условиях
составляет 8-12 квантов на молекулу CO2. Утилизация при Ф. энергии
солнечного излучения, достигающего земной пов-сти, составляет не более 0,1%
всей ФАР. Наиб. продуктивные растения (напр., сахарный тростник) в среднем за
год усваивают ок. 2% энергии падающего излучения, а зерновые культуры - до 1%.
Обычно суммарная продуктивность Ф. ограничена содержанием CO2 в атмосфере
(0,03-0,04% по объему), интенсивностью света и т-рой. Зрелые листья шпината
в атмосфере нормального состава при 25 0C на свету насыщающей интенсивности
(при солнечном освещении) дают неск. литров O2 в час на грамм хлорофилла
или на килограмм сухого веса. Для водорослей Chlorella pyrenoidosa при 35 0C
повышение концентрации CO2 от 0,03 до 3% позволяет повысить выход
O2 в 5 раз, такая активация является предельной.
Бактериальный Ф. и общее
ур-ние Ф. Наряду с Ф. высших растений и водорослей, сопровождаемым выделением
O2, в природе осуществляется бактериальный Ф., в к-ром окисляемым
субстратом является не вода, а др. соединения, обладающие более выраженными
восстановит. св-вами, напр. H2S, SO2. Кислород при бактериальном
Ф. не выделяется, напр.:
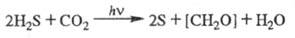
Фотосинтезирующие бактерии
способны использовать не только видимое, но и ближнее ИК излучение (до 1000
нм) в соответствии со спектрами поглощения преобладающих в них пигментов - бактериохлорофиллов.
Бактериальный Ф. не имеет существенного значения в глобальном запасании солнечной
энергии, но важен для понимания общих механизмов Ф. Кроме того, локально бескислородный
Ф. может вносить существенный вклад в суммарную продуктивность планктона. Так,
в Черном море кол-во хлорофилла и бактериохлорофил-ла в столбе воды в ряде мест
приблизительно одинаково.
Учитывая данные о Ф. высших
растений, водорослей и фотосинтезирующих бактерий, обобщенное ур-ние Ф. можно
записать в виде:
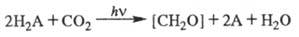
А - кислород в случае высших
растений и водорослей, S либо др. элементы - в бактериальном Ф.
Мол. механизм Ф. и структура
фотосинтетич. аппарата.
С использованием изотопных
меток показано, что источником O2 в Ф. является только вода:

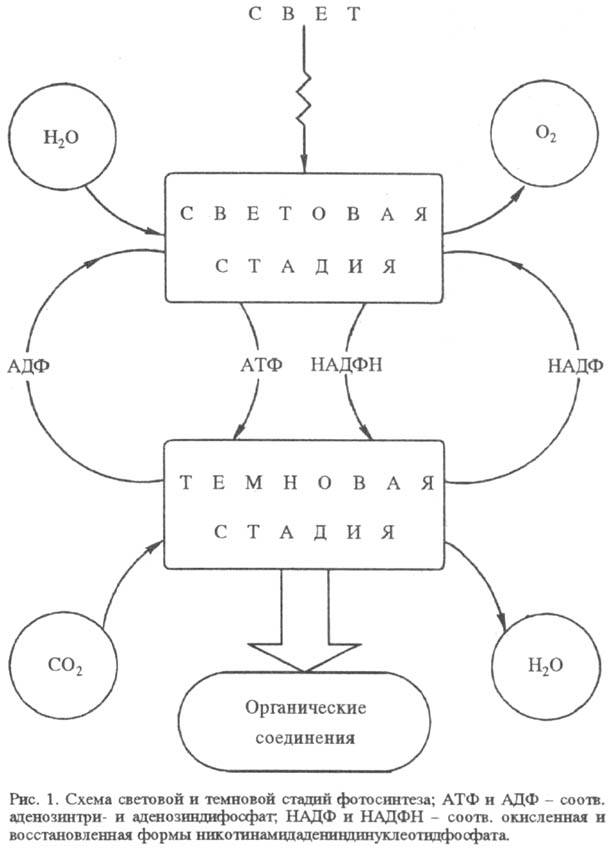
Ф. пространственно и во
времени разделяется на два сравнительно обособленных процесса: световую стадию
окисления воды и темновую стадию восстановления CO2 (рис. 1). Обе
эти стадии осуществляются у высших растений и водорослей в специализир. органеллах
клетки - хлоропластах. Исключение - синезеленые водоросли (цианобактерии), у
к-рых нет аппарата Ф., обособленного от цитоплазматич. мембран.
Хлоропласт, представляющий
собой замкнутую структуру, отделенную от остальной части клетки оболочкой, заключает
в себе весь фотосинтетич. аппарат. Световая стадия реализуется в мембранных
структурах хлоропласта (т. наз. тилакои-дах), тогда как темновая стадия происходит
в жидком содержимом хлоропласта (строме) при участии водорастворимых ферментов.
У фотосинтезирующих бактерий хлоропласты отсутствуют, но световая стадия также
осуществляется в мембранных образованиях - в т. наз. хроматофорах.
Световая стадия. Миним.
функциональная единица, еще способная осуществлять световую стадию Ф.,- тилакоид.
Он представляет собой микроскопич. плоский диск, образованный белковолипидными
мембранами, в к-рых находятся пигменты. В эти мембраны встроены все компоненты,
необходимые для окисления воды, восстановления кофермента никотинамиддинуклеотидфосфата
(НАДФ) до НАДФН и синтеза АТФ из аденозиндифосфата. Световая стадия инициируется
поглощением кванта света пигментами, организованными в спец. светособирающие
комплексы. Среди пигментов преобладает хлорофилл а. К вспомогат. пигментам
относятся хлорофилл b, каротиноиды и др. Наличие светособирающей структуры
из неск. сотен или десятков молекул пигментов на каждый фотохимически активный
(реакционный) центр на 2-3 порядка увеличивает сечение захвата излучения и обеспечивает
возможность Ф. при слабом освещении.
Часть вспомогат. пигментов,
спектрально наиб. близких к фотохимически активному хлорофиллу, непосредственно
окружает каждый из реакционных центров, образуя т. наз. антенны.
Высокая эффективность переноса
возбуждения от молекулы, поглотившей квант, к фотохим. центру определяется спектр.
св-вами и структурной организацией пигментов светособирающего
комплекса и антенны, окружающей фотохим. центр. Эти пигменты обеспечивают передачу
возбуждения за время менее 100 пс в пределах времени жизни синглетно возбужденного
состояния хлорофилла.
В реакц. центре Ф., куда
почти со 100%-ной вероятностью переносится возбуждение, происходит первичная
р-ция между фотохимически активной молекулой хлорофилла а (у бактерий
- бактериохлорофилла) и первичным акцептором электрона (ПА). Дальнейшие р-ции
в тилакоидных мембранах происходят между молекулами в их осн. состояниях и не
требуют возбуждения светом. Эти р-ции организованы в электронтранспортную цепь
- последовательность фиксированных в мембране переносчиков электрона. В электронтранс-портной
цепи высших растений и водорослей содержится два фотохим. центра (фотосистемы),
действующих последовательно (рис. 2), в бактериальной электронтранспортной цепи
- один (рис. 3).
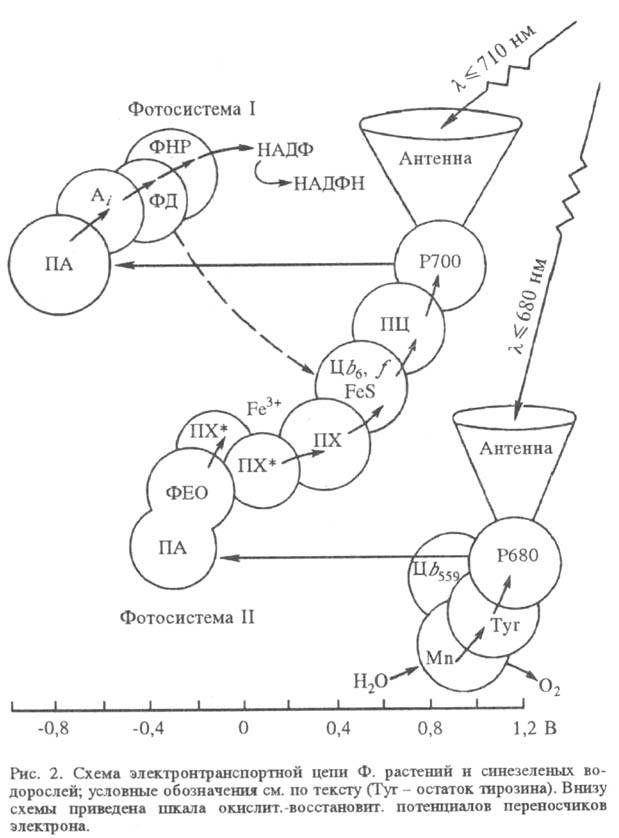
В фотосистеме II высших
растений и водорослей синглетно возбужденный хлорофилл а в центре Р680
(число 680 обозначает, что максимум спектральных изменений системы при возбуждении
светом находится вблизи 680 нм) отдает электрон через промежуточный акцептор
к феофитину (ФЕО, безмагниевый аналог хлорофилла), образуя катион-радикал 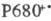 . Анион-радикал восстановленного феофитина служит далее донором электрона для
связанного пластохинона (ПХ*; отличается от убихинонов заместителями в хиноидном
кольце), координированного с ионом Fe3+ (в бактериях имеется аналогичный
Fе3+-убихинонный комплекс). Далее электрон переносится по цепи, включающей
свободный пластохинон (ПХ), присутствующий в избытке по отношению к остальным
компонентам цепи, затем цитохромы (Ц) b6 и f, образующие
комплекс с железо-серным центром, через медьсодержащий белок
пластоцианин (ПЦ; мол. м. 10400) к реакционному центру фотосистемы I.
. Анион-радикал восстановленного феофитина служит далее донором электрона для
связанного пластохинона (ПХ*; отличается от убихинонов заместителями в хиноидном
кольце), координированного с ионом Fe3+ (в бактериях имеется аналогичный
Fе3+-убихинонный комплекс). Далее электрон переносится по цепи, включающей
свободный пластохинон (ПХ), присутствующий в избытке по отношению к остальным
компонентам цепи, затем цитохромы (Ц) b6 и f, образующие
комплекс с железо-серным центром, через медьсодержащий белок
пластоцианин (ПЦ; мол. м. 10400) к реакционному центру фотосистемы I.
Центры 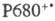 быстро восстанавливаются, принимая электрон через ряд промежут. переносчиков
от воды. Образование O2 требует последоват. четырехкратного возбуждения
реакционного центра фотосистемы П и катализируется мембранным комплексом,
содержащим Mn.
быстро восстанавливаются, принимая электрон через ряд промежут. переносчиков
от воды. Образование O2 требует последоват. четырехкратного возбуждения
реакционного центра фотосистемы П и катализируется мембранным комплексом,
содержащим Mn.
Хлорофилл a в фотосистеме
I, имеющий максимум поглощения вблизи 700 нм (центр Р700), является первичным
фотовозбуждаемым донором электрона, к-рый он отдает первичному акцептору (ПА;
его природа однозначно не установлена), а затем, через ряд промежут. переносчиков
(Ai) -растворимому белку ферредоксину (ФД), восстанавливающему
с помощью фермента ферредоксин-НАДФ-редуктазы (ФНР) НАДФ до НАДФН. Катион-радикал
окисленного пигмента 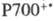 восстанавливается пластоцианином.
восстанавливается пластоцианином.
В зрелых хлоропластах имеются
граны (стопки тилакои-дов), в мембранах к-рых присутствуют все компоненты злек-тронтранспортной
цепи, и т. наз. агранальные тилакоиды, не содержащие фотосистемы II.
Благодаря асимметрич. расположению
компонентов электронтранспортной цепи относительно плоскости мембраны при разделении
зарядов между хлорофиллом в каждом из двух фотосинтетич. центров и акцептором
электрона на тилако-идной мембране создается разность электрич. потенциалов
(плюс - на внутренней, минус - на внешней ее стороне). Перенос электрона пластохиноном
сопровождается транспортом протонов, к-рые захватываются снаружи тилакоида при
восстановлении пластохинона и освобождаются внутрь тилакоида при окислении пластогидрохинона.
Перенос электронов сопряжен с синтезом АТФ из аденозиндифосфата (АДФ) и неорг.
фосфата. Предполагают, что обратный транспорт протонов из тилакоидов в строму
через белковый сопрягающий фактор (Н+-АТФ-синтетазу) сопровождается
образованием АТФ.

Фотосистема I может действовать
автономно без контакта с системой II. В этом случае циклич. перенос электрона
(на схеме показан пунктиром) сопровождается синтезом АТФ, а не НАДФН. Образующиеся
в световой стадии кофермент
НАДФН и АТФ используются
в темновой стадии Ф., в ходе к-рой снова образуется НАДФ и АДФ.
Электронтранспортные цепи
фотосинтезирующих бактерий в основных своих чертах аналогичны отдельным фрагментам
таковых в хлорогшастах высших растений. На рис. 3 показана электронтранспортная
цепь пурпурных бактерий.
Темновая стадия Ф. Все
фотосинтезирующие организмы, выделяющие O2, а также нек-рые фотосинтезирующие
бактерии сначала восстанавливают CO2 до фосфатов Сахаров в т. наз.
цикле Калвина. У фотосинтезирующих бактерий встречаются, по-видимому, и др.
механизмы. Большинство ферментов цикла Калвина находится в растворимом состоянии
в строме хлоропластов.
Упрощенная схема цикла
показана на рис. 4. Первая стадия - карбоксилирование рибулозо-1,5-дифосфата
и гидролиз продукта
с ооразованием двух молекул 3-фосфоглицериновой к-ты. Эта С3-кислота
фосфорили-руется АТФ с образованием 3-фос-фоглицероилфосфата, к-рый затем восстанавливается
НАДФН до гли-церальдегид-3-фосфата. Полученный триозофосфат затем вступает в
ряд р-ций изомеризации, конденсации и перегруппировок, дающих 3 молекулы рибулозо-5-фосфата.
Последний фосфорилируется при участии АТФ с образованием риоу-лозо-1,5-дифосфата
и, т. обр., цикл замыкается. Одна из 6 образующихся молекул глицеральдегид-3-фос-фата
превращается в глюко-зо-6-фосфат и используется затем для синтеза крахмала либо
выделяется из хлоропласта в цитоплазму. Глицеральдегид-3-фосфат может также
превращаться в 3-глицеро-фосфат и затем в липиды. Триозофосфаты,
поступающие из хлоропласта, превращаются в осн. в сахарозу, к-рая переносится
из листа в др. части растения.
В одном полном обороте
цикла Калвина расходуется 9 молекул АТФ и 6 молекул НАДФН для образования одной
молекулы 3-фосфоглицериновой к-ты. Энергетич. эффективность цикла (отношение
энергии фотонов, необходимых для фотосинтеза АТФ и НАДФН, к DG0 образования
углевода из CO2) с учетом действующих в строме хлоропласта концентраций
субстратов составляет 83%. В самом цикле Калвина нет фотохим. стадий, но световые
стадии могут косвенно влиять на него (в т. ч. и на р-ции, не требующие АТФ или
НАДФН) через изменения концентраций ионов Mg2+ и H+, а
также уровня восстановленности ферредоксина.
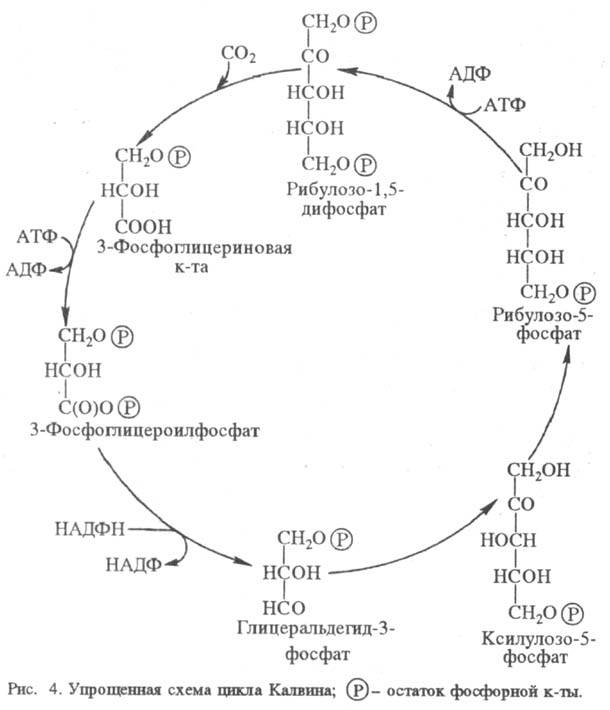
Нек-рые высшие растения,
приспособившиеся к высокой интенсивности света и к теплому климату (напр., сахарный
тростник, кукуруза), способны предварительно фиксировать CO2 в дополнит.
С4-цикле. При этом CO2 сначала включается в обмен четырехуглеродных
дикарбоновых к-т, к-рые затем декарбоксилируются там, где локализован цикл Калвина.
С4-Цикл характерен для растений с особым анатомич. строением листа
и разделением ф-ций между двумя типами клеток: мезофильных, где сосредоточено
карбоксилирование фосфоенолиировиноградной к-ты, и клеток обкладки сосудистого
пучка, где функционирует цикл Калвина. Образующаяся в С4-цикле щавелевоуксусная
кислота восстанавливается НАДФН до яблочной, к-рая перемещается в клетки сосудистой
обкладки и здесь подвергается окислит, декарбоксили-рованию, образуя пировиноградную
к-ту, CO2 и НАДФН. Два последних используются в цикле Калвина, а
пировиноградная к-та возвращается в С4-цикл (рис. 5). Физиол. смысл
С4-цикла состоит в запасании CO2 и повышении, т. обр.,
общей эффективности процесса.
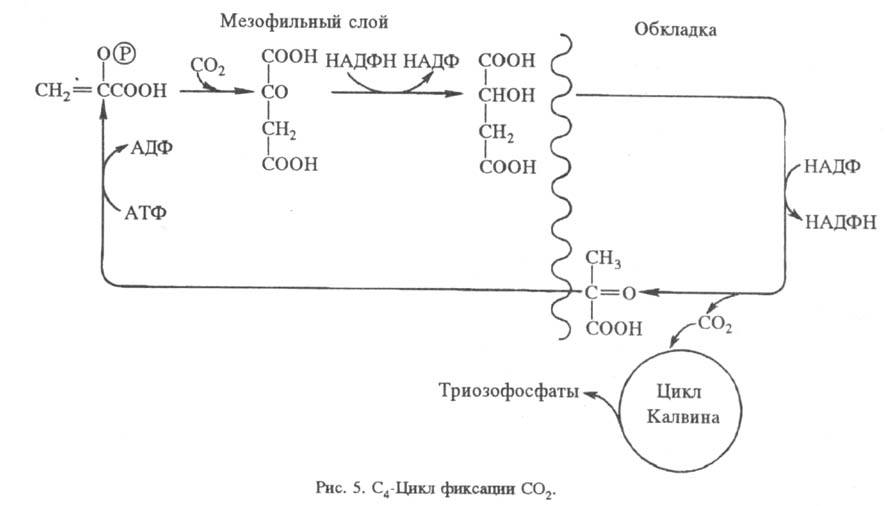
Для кактусов, молочая и
др. засухоустойчивых растений характерно частичное разделение фиксации CO2
и Ф. во времени (САМ-обмен, или обмен по типу толстянковых; САМ сокр.
от англ. Crassulaceae acid metabolism). Днем устьица (каналы, через к-рые
осуществляется газообмен с атмосферой) закрываются, чтобы уменьшить испарение
воды. При этом поступление CO2 также затруднено. Ночью устьица открываются,
происходит фиксация CO2 в виде фосфоенол-пировиноградной к-ты с образованием
С4-кислот, к-рые днем декарбоксилируются, а освобождаемый при этом
CO2 включается в цикл Калвина (рис. 6).
Ф. галобактерий. Единственный
известный в природе не-хлорофилльный способ запасания энергии света осуществляют
бактерии Halobacterium halobium. Ha ярком свету при пониженной концентрации
O2 они образуют в своих мембранах пурпурный белок бактериородопсин.
В результате индуцированной светом цис-транс-изомеризации ретиналя
(хромофора этого пигмента) происходит поглощение H+ и синтез АТФ.
Последний используется для частичного обеспечения энерге-тич. потребностей клетки.
Историческая справка.
Ок. 1770 Дж. Пристли обнаружил, что растения выделяют O2. В 1779
Я. Ингенхауз установил, что для этого необходим свет и что O2 выделяют
только зеленые части растений. Ж. Сенебье в 1782 показал, что для питания растений
требуется CO2; в нач. 19 в. H. Соссюр, исходя из закона сохранения
массы, подтвердил, что большая часть массы растений создается из CO2
и воды. В 1817 П. Пельтье и Ж. Каванту выделили зеленый пигмент хлорофилл. Позже
К.А. Тимирязев показал близость спектра действия Ф. и спектра поглощения хлорофилла.
Ю. Сакс в сер. 19 в., по-видимому, первым осознал, что этот продукт накапливается
в хлоропластах, а Т.В. Энгельман доказал, что именно там же выделяется и O2.
В работах Ф. Блэкмана (1905),
P. Эмерсона и У. Арнолда (1932), а также P. Хилла (1936-41) показано наличие
световой и темновой стадий Ф. и экспериментально реализована световая стадия
в отсутствие CO2 с использованием искусств. акцепторов электрона.
Тем самым были получены подтверждения представлений об образовании O2
путем окисления воды. Окончательно это было доказано масс-спектрометрич. методом
(С. Рубен, M. Камен, а также А.П. Виноградов и Р.В. Тейс, 1941).
В 1935-41 К. Ван Ниль обобщил
данные по Ф. высших растений и бактерий и предложил общее ур-ние, охватывающее
все типы Ф. X. Гаффрон
и К. Воль, а также Л. Дёйсенс в 1936-52 на основе количеств. измерений выхода
продуктов Ф. поглощенного света и содержания хлорофилла сформулировали представление
о "фотосинтетич. единице" - ансамбле молекул пигмента, осуществляющих
светосбор и обслуживающих фотохим. центр.
В 40-50-х гг. M. Калвин,
используя изотоп 14C, выявил механизм фиксации CO2. Д.
Арнон (1954) открыл фотофос-форилирование (инициируемый светом синтез АТФ из
АДФ и H3PO4) и сформулировал концепцию электронного транспорта
в мембранах хлоропластов. P. Эмерсон и Ч.M. Льюис (1942-43) обнаружили резкое
снижение эффективности фотосинтеза при 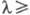 700
нм (красное падение, или первый эффект Эмерсона), а в 1957 Эмерсон наблюдал
неаддитивное усиление Ф. при добавлении света низкой интенсивности с
700
нм (красное падение, или первый эффект Эмерсона), а в 1957 Эмерсон наблюдал
неаддитивное усиление Ф. при добавлении света низкой интенсивности с 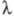 650 нм к дальнему красному свету (эффект усиления, или второй эффект Эмерсона).
На этом основании в 60-х гг. сформулировано представление о последовательно
действующих фотосистемах
в электронтранспортной цепи Ф. с максимумами в спектрах действия вблизи 680
и 700 HM.
650 нм к дальнему красному свету (эффект усиления, или второй эффект Эмерсона).
На этом основании в 60-х гг. сформулировано представление о последовательно
действующих фотосистемах
в электронтранспортной цепи Ф. с максимумами в спектрах действия вблизи 680
и 700 HM.
Осн. закономерности образования
O2 при окислении воды в Ф. установлены в работах Б. Кока и П. Жолио
(1969-70). Близится к завершению выяснение мол. организации мембранного комплекса,
катализирующего этот процесс. В 80-х гг. методом рентгеновского структурного
анализа детально изучена структура отдельных компонентов фотосинтетич. аппарата,
включая реакционные центры и светособирающие комплексы (И. Дайзенхофер, X. Михель,
P. Хубер).
Лит.: Клейтон Р.,
Фотосинтеч. Физические механизмы и химические модели, пер. с англ., M., 1984;
"Ж. Всес. хим. об-ва им. Д.И. Менделеева", 1986, т. 31, № 6; Фотосинтез,
под ред. Говинджи, пер. с англ., т. 1-2, M., 1987; Итоги науки и техники, сер.
Биофизика, т. 20-22, M., 1987. М.Г. Голъдфелъд.


