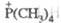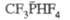ФОСФОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ,
содержат в молекулах атом P, связанный с орг. радикалами непосредственно
или через гетероатом (О, S, N и др.). Первые Ф. с. (смесь метилфосфинов) получены
в 1846 Л. Тенаром и И. Берцелиусом при метилировании фосфида Ca.
Классификация. Ф.
с. можно классифицировать по кол-ву заместителей у атома P (координационному
числу), к-рых м. б. от 1 до 6. Примеры соед. с разл. координационным числом
атома P приведены в табл. 1.
Табл.1.- ПРИМЕРЫ ФОСФОРОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ С РАЗЛИЧНЫМИ КООРДИНАЦИОННЫМИ ЧИСЛАМИ АТОМА P
|
Координационное
число |
Соединение |
||
|
1 |
(CH3)3CC |
||
|
2 |
[(СНз)2]N]2С
= РН |
||
|
3 |
P(OCНз)3;
|
||
|
4 |
(C4H9)3PO;
|
||
|
5 |
C6H5(CH3)2P(OC2H5)2 |
||
|
6 |
|
||
По др. классификации, охватывающей
наиб. распространенные Ф. с., выделяют фосфорсодержащие к-ты (см. также Фосфора
кислоты)и их производные (табл. 2), а также фосфины и родств. соединения.
Табл.2.- НАЗВАНИЕ НЕКОТОРЫХ
КИСЛОТ ФОСФОРА, ИХ ЭФИРОВ И СОЛЕЙ
|
Формула |
Кислоты |
Эфиры и соли |
||
|
Производные пятивалентного
P |
||||
|
(HO)3PO |
Ортофосфорная к-та
(фосфорная к-та) |
Фосфаты |
||
|
RP(O)(OH)2 |
Фосфоновые к-ты |
Фосфонаты |
||
|
R2P(O)OH |
Фосфиновые к-ты |
Фосфинаты |
||
|
Производные трехвалентного
P |
||||
|
HP(OH)2* |
Гипофосфористая
к-та (фосфорноватистая к-та) |
Гипофосфиты |
||
|
P(OH)3 |
Фосфористая к-та |
Фосфиты |
||
|
RP(OH)2* |
Фосфонистые к-ты |
Фосфониты |
||
|
R2POH* |
Фосфинистые к-ты |
Фосфиниты |
||
* Используются ф-лы таутомерных
форм к-т с трехвалентным атомом P.
К Ф. с. второго типа относятся
первичные RPH2, вторичные R2PH и третичные R3P
фосфины, а также окисленные формы последних: фосфиноксиды R3PO,
фосфинсульфиды R3PS (см. Фосфиноксиды и фосфинсульфиды), фосфинселениды
R3PSe, фосфазосоединения R3P = NR и фосфинал-килены
R3P = CR2. Ко второму типу принадлежат также фосфониевые
соединения 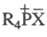 и фосфораны R5P.
и фосфораны R5P.
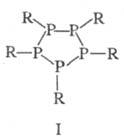
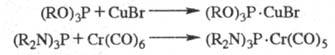
Известны также полифосфины
и их производные [напр., дифосфины R2P — PR2, цик- лопентафосфины
(ф-ла I)] и металлокомплексы
[напр., (RO)3P· CuBr, (R3P)3RhCl, R3PO·
SnR4]. Во всех приведенных ф-лах радикалы R м. б. одинаковыми или
различными.
Распространение в природе.
Разнообразные Ф. с. содержатся в живых организмах, где выполняют ответственные
биол. ф-ции. К ним, напр., относятся нуклеиновые кислоты, нуклеотиды, фосфаты
моносахари-дов (напр., глюкозо-1- и глюко-зо-6-фосфаты), нуклеозидмоноцик-лофосфаты
(напр., аденозинмоно-фосфат циклический), разл. типы фосфолипидов
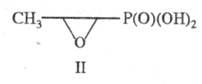
и др. К прир. Ф. с. также относят производные фосфоновых к-т - антибиотик
фосфомицетин (II), фосфорные аналоги 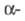 и
b-аминокарбоновых кислот и пептиды на их основе.
и
b-аминокарбоновых кислот и пептиды на их основе.
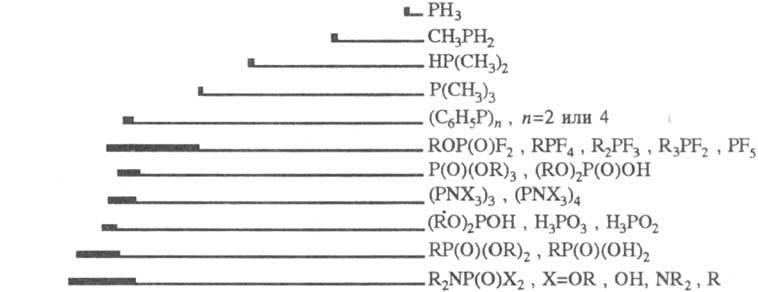
Физические свойства.
Ф. с. могут быть газами, жидкостями или твердыми в-вами. Для идентификации
и изучения их св-в используют все осн. физ.-хим. методы, но в первую очередь
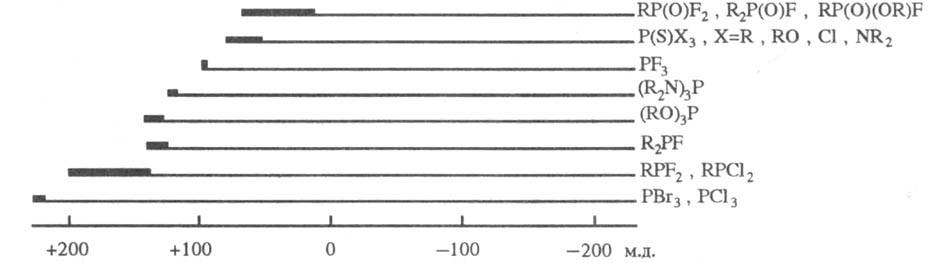
-спектроскопию ЯMP31P. Величины хим. сдвигов определяются гл. обр.
электроотрицательностями атомов, связанных с атомом P, и степенью обратного
p-дативного взаимод. с ним. Сигналы ЯМР31Р располагаются в очень
широкой области значений (неск. сотен м. д.) и проявляют при этом выраженную
специфичность (рис.).
Химические свойства.
1. Таутомерия. Для гидрофос-форильных соединений и тиогидрофосфорильных
соед. известен такой вид прототропии:
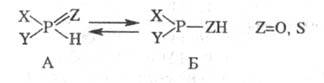
Как правило, равновесие
сдвинуто в сторону формы А, однако при наличии сильных электроноакцепторных
заместителей X и Y [напр., (CF3)2POH] - в сторону Б.
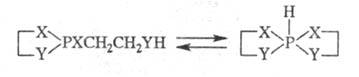
Циклич. средние фосфиты
и амидофосфиты с протонодо-норной группой в боковой цепи могут частично или
полностью превращаться в гидроспирофосфорановые формы:
Тиокислоты фосфора характеризуются
особым видом прототропии:
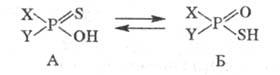
Увеличение электроноакцепторных
св-в заместителей X и Y приводит к накоплению формы Б. В химии Ф. с. известны
и фосфотропные процессы, напр.:
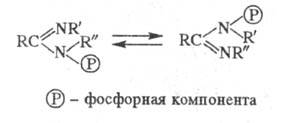
Если радикалы R и R' одинаковые,
то процесс является вырожденным.
Особый вид таутомерии (псевдовращение)характерен для фосфоранов, к-рые способны обменивать у атома P заместители,
занимающие аксиальные и экваториальные положения:
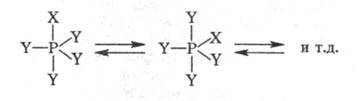
Принцип псевдовращения
широко используют для объяснения механизмов реакций Ф. с.
Области хим. сдвигов
31P фосфорорг. соед. относительно 85%-ной H3PO4;
производные двухкоординационного P характеризуются хим. сдвигами в очень сильных
полях (до 450 мд.).
2. Диспропорционирование.
Производные пяти-и особенно трехвалентного P, в молекулах к-рых атомы P связаны
с разл. электроноакцепторными группами, склонны к межмол. обмену этими группами,
напр.:
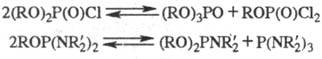
Диспропорционирование обычно
катализируется к-тами. Наличие циклич. фрагментов в молекуле препятствует диспро-порционированию.
3. Фосфорилирование. С
помощью Ф.с., в молекулах к-рых атом P связан с электроноакцепторной (уходящей)
группой, можно вводить фосфорный остаток в состав нукле-офилов (осуществлять
(расформирование). В качестве уходящих групп обычно выступают галогениды,
алкокси-, тиоал-коксигруппы и др., напр.:

К-ты также используют в
качестве фосфорилирующих ср-в, однако, как правило, после предварит, активации,
т. е. после превращения кислотного гидроксила в легкоуходящую группу,
напр.:
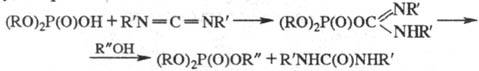
Производные к-т с трехвалентным
атомом P проявляют более высокую фосфорилирующую активность, чем производные
к-т с пятивалентным атомом P.
4. Важнейшие р-ции производных
трехвалентного P. Эти соед. легко окисляются, присоединяют атомы S, Se, Те,
Hal, иминируются, алкилируются:
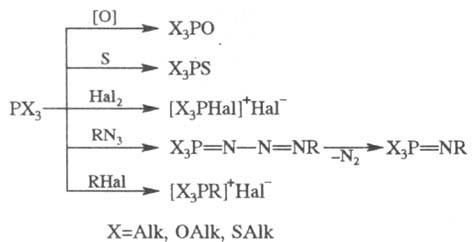
Если X = OAlk, SAlk, то
первичный продукт взаимод. PX3 с RHal далее распадается с образованием
фосфорильного (тиофосфорильного) соед. (Арбузова реакция):
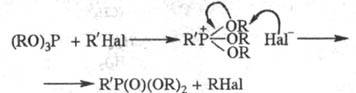
При взаимод. средних фосфитов
с a-галогенкарбонильны-ми соед. может происходить как р-ция Арбузова, так и
иной процесс, приводящий к фосфовиниловым эфирам (Перкова реакция):

Многие производные трехвалентного
P присоединяются к сопряженным диенам и другим 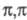 -сопряженным
системам; образующиеся продукты могут выделяться как целевые в-ва либо без выделения
вступать в дальнейшие превращения, напр.:
-сопряженным
системам; образующиеся продукты могут выделяться как целевые в-ва либо без выделения
вступать в дальнейшие превращения, напр.:
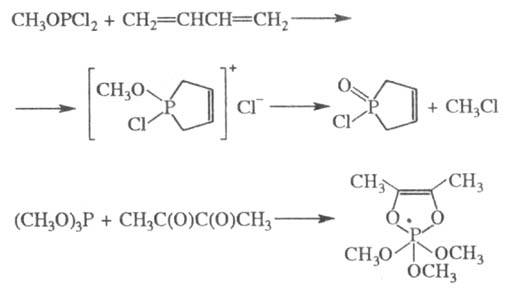
Соед. с трехвалентным атомом
P легко образуют комплексы с производными переходных металлов, напр.:
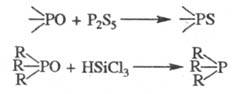
5. Важнейшие р-ции производных пятивалентного P. Кислород фосфорильной группы в таких Ф. с. заменяется на серу под действием P2S5. В молекулах третичных фосфиноксидов он элиминируется при восстановлении трихлорсиланом:
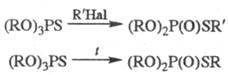
Сложные эфиры тионовых
к-т при действии алкилгалоге-нидов или при нагр. претерпевают muoн-тиольную
перегруппировку:
В большинстве фосфорильных
соед. со связью С — P  -ме-тиленовые
протоны фосфорильной группы подвижны, что приводит к их депротонированию при
действии сильных оснований. Образующиеся карбанионы при взаимод. с альдегидами
и кетонами образуют олефины (Корнера реакция):
-ме-тиленовые
протоны фосфорильной группы подвижны, что приводит к их депротонированию при
действии сильных оснований. Образующиеся карбанионы при взаимод. с альдегидами
и кетонами образуют олефины (Корнера реакция):
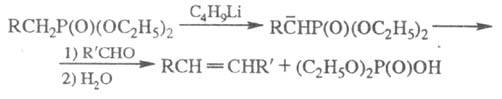
Подобная р-ция происходит
под действием фосфиналкиле-нов (Виттига реакция):

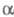 -Гидроксифосфонаты при нагр. в присут. оснований могут превращаться в фосфаты
(фосфонатфосфатная перегруппировка):
-Гидроксифосфонаты при нагр. в присут. оснований могут превращаться в фосфаты
(фосфонатфосфатная перегруппировка):
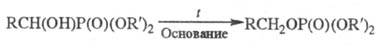
Фосфорильные соед. образуют
комплексы с разл. переходными и непереходными металлами с участием кислорода
фосфорильной группы. Устойчивость комплексов обычно сильно возрастает при хелатировании
металла.
Получение Ф. с. Общий
путь синтеза Ф. с. включает три последоват. стадии: 1) получение элементарного
фосфора из минер. сырья; 2) превращение фосфора в неорг. производные (P4O10,
PCl3, PCl5, POCl3); 3) получение Ф. с. взаимод.
этих производных со спиртами, аминами, альдегидами, олефинами и др. Возможно
также превращение фосфора в Ф. с., минуя неорг. производные (напр., путем взаимод.
элементарного P с алкилгалогенидами или спиртами).
Среди многочисленных способов
синтеза конкретных Ф. с. (они приведены в статьях о группах соед.) выделяют
методы, позволяющие получать соед. со связью С — P. Эти методы приведены ниже.
Фосфины и гидрофосфорильные
(тиогидрофосфорильные) соед. в условиях гомолитич. р-ций легко присоединяются
к олефинам с образованием связи C-P:
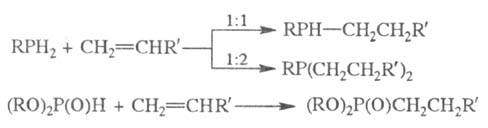
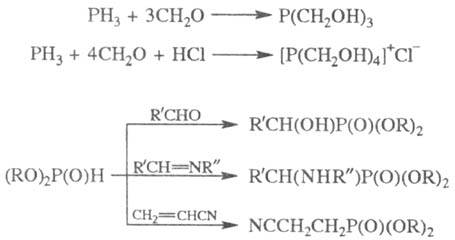
Эти же соед. в условиях
гетеролитич. р-ций присоединяются по связям C = O, C = N, C = S, C = C с образованием
разнообразных функционализир. Ф. с.:
При алкилировании и арилировании
средних эфиров к-т трехвалентного P образуется новая связь C-P (р-ция Арбузова).
Аналогично осуществляется р-ция с использованием металлич. солей гидрофосфорильных
соед. (Михаэлиса - Бек-кера реакция):

Этот синтез целесообразно
проводить в условиях межфазного катализа. Галогенангидриды
орг. к-т фосфора образуются при присоединении PCl5 и родственных
в-в к непредельным соед.:

Эта р-ция хорошо идет в
случае использования виниловых эфиров.
При взаимод. алканов или
алкенов с PCl3 и кислородом образуются сложные смеси в-в, осн. компонентами
к-рых являются дихлорангидриды фосфоновых к-т (см. также Окисли-лительное
хлорфосфонирование):
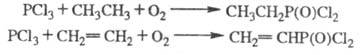
Ароматич. соед. легко фосфорилируются
PCl3, P2S5 и др. электрофилами в условиях р-ции
Фриделя - Крафтса:
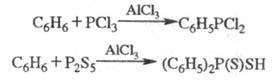
Алкилгалогениды в присуг. к-т Льюиса алкилируют PCl3 с образованием связи C-P (Клея - Киннера - Перрена реакция):
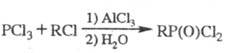
При нагр. белого или красного
P с арил- или алкилгалогенидами образуется смесь хлорфосфинов. Вариант этой
р-ции, представляющий практич. значение,- алкилирование P в присут. иода.
Связь C-P образуется также при взаимод. галогенангид-ридов к-т фосфора с металлоорг. соед.; при этом один или неск. атомов галогена обмениваются на углеводородные радикалы:
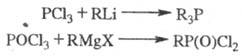
В нек-рых случаях в эти
р-ции нуклеоф. замещения по атому P вступают и эфиры к-т фосфора.
Применение. Ф. с.
широко используют в технике, с. х-ве и медицине. Многие из них в качестве комплексонов
и экстрагентов применяются при получении цветных и редких металлов; для борьбы
с коррозией и отложением солей в техн. водах; в качестве стабилизаторов и пластификаторов
полимеров; в качестве мономеров для ионообменных и термостабильных полимеров,
присадок для смазочных масел и гидравлич. жидкостей. Многие Ф. с.- лек. ср-ва,
пестициды, фпотореагенты, ПАВ; нек-рые фосфаты и фосфины, в т.ч. обладающие
оптич. активностью, применяют для получения металлокомплексных катализаторов.
Среди Ф. с. имеются отравляющие вещества. См. также Фосфорсодержащие гете-роциклы.
Лит.: Кабачник М.И., Фосфорорганические вещества, M., 1967; Ни-фантьев Э.Е., Химия фосфорорганических соединений, M., 1971; Пурдела Д., Вылчану Р., Химия органических соединений фосфора, пер. с рум., M., 1972; Арбузов А.Е., Избранные труды по химии фосфорорганических соединений, M., 1976; Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер.с англ., M., 1982; Нифантьев Э.Е., Kухарева Т.С., Обзор монографий и обзоров по химии фосфорорганических соединений, M., 1989; S a s s е К., в кн.: Houben-Weyl, Methoden der organischen Cheniie, 4 Aufl., Bd 12/1, Bd 12/2, Stuttg., 1963-64; Organic phosphorus compounds, eds, G.M. Kosolapoff, L. Maier, v. 1-7, N.Y.- [a.o.], 1972-76; Dictionary of organo-phosphorus compounds, ed. R.S. Edmundson, L., 1988. Э.Е. Нифантьев.



 P
P