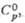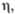ФОСФОРНАЯ КИСЛОТА
(ортофосфорная к-та) H3PO4, мол. м. 97,995; бесцв. гигроскопичные
кристаллы моноклинной сингонии (а = 0,5762 нм, b= 0,4831 нм, с
=1,1569 нм, 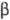 = 95,31°, пространств, гр. Р21/с); расплывается на воздухе;
т. пл. 42,50 С; плотн. 1,88 г/см3;
= 95,31°, пространств, гр. Р21/с); расплывается на воздухе;
т. пл. 42,50 С; плотн. 1,88 г/см3; 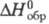 -1283 кДж/моль; наиб. стабильное соед. в ряду кислородсодержащих к-т фосфора.
В расплавленном состоянии склонна к переохлаждению; при 15 0C образует
густую маслянистую жидкость, при -121 0C- стеклообразную массу.
-1283 кДж/моль; наиб. стабильное соед. в ряду кислородсодержащих к-т фосфора.
В расплавленном состоянии склонна к переохлаждению; при 15 0C образует
густую маслянистую жидкость, при -121 0C- стеклообразную массу.
F. к. смешивается
с водой в любых соотношениях. Разб. водные р-ры имеют кисловатый вкус. Из высококонц.
р-ров кристаллизуется в виде гемигидрата (полугидрата) H3PO4·0,5H2O-
бесцв. кристаллы моноклинной сингонии (а = 0,7922 нм, b = 1,2987
нм, с = 0,7470 нм, 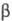 =
109,9°; пространств, гр. Р21/a). Молекула безводной H3PO4
и ее кристаллогидрата содержит тетраэдрич. группу PO4. В безводной
Ф. к. образуются водородные связи типа P — О — H ... O = P (рис.
1) (расстояние между атомами О 0,253 нм), к-рые удерживают структуры PO4
в виде слоев, параллельных одной из плоскостей кристалла. Водородные связи сохраняются
и в конц. (70-80%) р-рах Ф. к., что отчасти обусловливает ее сиропообразную
природу. В разб. до 40-50% р-рах отмечена более устойчивая водородная связь
фосфат-анионов с молекулами воды, а не с др. фосфат-анионами. В р-рах Ф. к.
имеет место обмен атомами кислорода между группами PO4 и водой.
=
109,9°; пространств, гр. Р21/a). Молекула безводной H3PO4
и ее кристаллогидрата содержит тетраэдрич. группу PO4. В безводной
Ф. к. образуются водородные связи типа P — О — H ... O = P (рис.
1) (расстояние между атомами О 0,253 нм), к-рые удерживают структуры PO4
в виде слоев, параллельных одной из плоскостей кристалла. Водородные связи сохраняются
и в конц. (70-80%) р-рах Ф. к., что отчасти обусловливает ее сиропообразную
природу. В разб. до 40-50% р-рах отмечена более устойчивая водородная связь
фосфат-анионов с молекулами воды, а не с др. фосфат-анионами. В р-рах Ф. к.
имеет место обмен атомами кислорода между группами PO4 и водой.
H3PO4
- сильная к-та, K1 7,1·10-3 (рКа
2,12), K2 6,2·10-8 (рКа 7,20),
K3 5,0·10-13 (рКа 12,32);
значения K1 и K2 зависят от т-ры. Диссоциация
по первой ступени экзотермична, по второй и третьей - эндотермична. Фазовая
диаграмма системы H3PO4 - H2O приведена на
рис. 2. Максимум кривой кристаллизации - при т-ре 302,4 К и содержании H3PO4
91,6% (твердая фаза - гемигидрат). В табл. приведены св-ва р-ров Ф. к.
ХАРАКТЕРИСТИКА ВОДНЫХ
РАСТВОРОВ H3PO4
|
Содержание, % по
массе |
T. затв., 0C |
T. кип., 0C |
кДж/(кг·К) |
Па ·с (25 0C) |
Уд. электрич. проводимость,
См/м (25 0C) |
Давление пара,
Па (25 0C) |
|||
|
H3PO4 |
P2O5 |
||||||||
|
5 |
3,62 |
0,8 |
100,10 |
4,0737 |
0,0010 |
10,0 |
3129,1 |
||
|
10 |
7,24 |
-2,10 |
100,20 |
3,9314 |
0,0011 |
18,5 |
3087,7 |
||
|
20 |
14,49 |
-6,00 |
100,80 |
3,6467 |
0,0016 |
18,3 |
2986,4 |
||
|
30 |
21,73 |
-11,80 |
101,80 |
3,3411 |
0,0023 |
14,3 |
2835,7 |
||
|
40 |
28,96 |
-21,90 |
103,90 |
3,0271 |
0,0035 |
11,0 |
2553,1 |
||
|
50 |
36,22 |
-41,90 |
104,00 |
2,7465 |
0,0051 |
8,0 |
2223,8 |
||
|
60 |
43,47 |
-76,9 |
114,90 |
2,4995 |
0,0092 |
7,2 |
1737,1 |
||
|
70 |
50,72 |
-43,00 |
127,10 |
2,3278 |
0,0154 |
6,3 |
1122,6 |
||
|
75 |
54,32 |
-17,55 |
135,00 |
2,2692 |
0,0200 |
5,8 |
805,2 |
||
Ф. к. при нормальных условиях
малоактивна и реагирует лишь с карбонатами, гидроксидами и нек-рыми металлами.
При этом образуются одно-, двух- и трехзамещенные фосфаты (см. Фосфаты неорганические).
При нагр. выше 80 0C реагирует даже с неактивными оксидами, кремнеземом
и силикатами. При повышенных т-рах Ф. к.- слабый окислитель для металлов. При
действии на металлич. пов-сть р-ром Ф. к. с добавками Zn или Mn образуется защитная
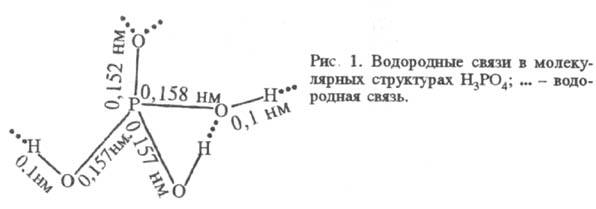
пленка (фосфатирование). Ф.к. при нагр. теряет воду с образованием последовательно
пиро- и метафосфорных к-т:
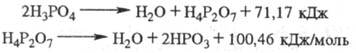
Фосфолеум (жидкий фосфорный
ангидрид, суперфосфорная к-та) включает к-ты, содержащие от 72,4 до 88,6% P2O5,
и представляет собой равновесную систему, состоящую из орто-, пиро-, Триполи-,
тетраполи- и др. фосфорных к-т (см. Фосфаты конденсированные). При разбавлении
суперфосфорной к-ты водой выделяется значит. кол-во тепла, и полифосфорные к-ты
быстро переходят в ортофосфорную.
От др. фосфорных к-т H3PO4
можно отличить по р-ции с AgNO3 - выпадает желтый осадок Ag3PO4.
Остальные фосфорные к-ты образуют белые осадки.
Получение. Ф. к.
в лаб. условиях легко получить окислением фосфора 32%-ным р-ром азотной к-ты:
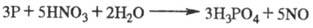
В пром-сти Ф. к. получают
термическим и экстракционным способами.
Термич. способ (позволяет
производить наиб. чистую Ф. к.) включает осн. стадии: сжигание (окисление) элементного
фосфора в избытке воздуха, гидратацию и абсорбцию полученного P4O10
(см. Фосфора оксиды), конденсацию Ф.к. и улавливание тумана из газовой
фазы. Существуют два способа получения P4O10: окисление
паров P (в пром-сти используют редко) и окисление жидкого P в виде капель или
пленки. Степень окисления P в пром. условиях определяется т-рой в зоне окисления,
диффузией компонентов и др. факторами. Вторую стадию получения термич. Ф. к.-
гидратацию P4O10 - осуществляют абсорбцией к-той (водой)
либо взаи-мод. паров P4O10 с парами воды. Гидратация (P4O10
+ 6H2O 4H3PO4) протекает через стадии образования полифосфорных
к-т. Состав и концентрация образующихся продуктов зависят от т-ры и парциального
давления паров воды.
4H3PO4) протекает через стадии образования полифосфорных
к-т. Состав и концентрация образующихся продуктов зависят от т-ры и парциального
давления паров воды.
Все стадии процесса м.
б. совмещены в одном аппарате, кроме улавливания тумана, к-рое всегда производят
в отдельном аппарате. В пром-сти обычно используют схемы из двух или трех осн.
аппаратов. В зависимости от принципа охлаждения газов существуют три способа
произ-ва термич. Ф.к.: испарительный, циркуляционно-испарительный, теплообмен-но-испарительный.
Испарит. системы, основанные на отводе теплоты при испарении воды или разб.
Ф. к., наиб. просты в аппаратурном оформлении. Однако из-за относительно большого
объема отходящих газов использование таких систем целесообразно лишь в установках
небольшой единичной мощности.
Циркуляционно-испарит.
системы позволяют совместить в одном аппарате стадии сжигания P, охлаждения
газовой фазы циркулирующей к-той и гидратации P4O10. Недостаток
схемы - необходимость охлаждения больших объемов к-ты. Теплообменно-испарит.
системы совмещают два способа отвода теплоты: через стенку башен сжигания и
охлаждения, а также путем испарения воды из газовой фазы; существенное преимущество
системы - отсутствие контуров циркуляции к-ты с насосно-холодильным оборудованием.
На отечеств. предприятиях
эксплуатируют технол. схемы с циркуляционно-испарит. способом охлаждения (двухбашен-ная
система). Отличит. особенности схемы: наличие дополнит.
башни для охлаждения газа, использование в циркуляционных контурах эффективных
пластинчатых теплообменников; применение высокопроизводит. форсунки для сжигания
P, обеспечивающей однородное тонкодисперсное распыление струи жидкого P и полное
его сгорание без образования низших оксидов.
Технол. схема установки
мощностью 60 тыс. т в год 100%-ной H3PO4 приведена на
рис. 3. Расплавленный желтый фосфор распыляется нагретым воздухом под давлением
до 700 кПа через форсунку в башне сжигания, орошаемой циркулирующей к-той. Нагретая
в башне к-та охлаждается оборотной водой в пластинчатых теплообменниках. Продукционная
к-та, содержащая 73-75% H3PO4, отводится из контура циркуляции
на склад. Дополнит, охлаждение газов из башни сжигания и абсорбцию к-ты производят
в башне охлаждения (гидратации), что снижает послед, температурную нагрузку
на электрофильтр и способствует эффективной очистке газов. Отвод теплоты в башне
гидратации осуществляется циркулирующей 50%-ной H3PO4,
охлаждаемой в пластинчатых теплообменниках. Газы из башни гидратации после очистки
от тумана H3PO4 в пластинчатом электрофильтре выбрасываются
в атмосферу. На 1 т 100%-ной H3PO4 расходуется 320 кг
P.
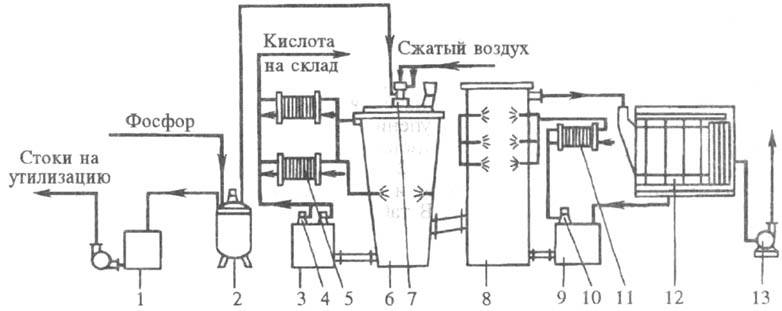
Рис. 3. Циркуляционная
двухбашенная схема произ-ва термич. H3PO4: 1 - сборник
кислой воды; 2 - хранилище фосфора; 3,9 - циркуляционные сборники; 4,10 - по-гружные
насосы; 5,11 - пластинчатые теплообменники; 6 - башня сжигания; 7 - фосфорная
форсунка; 8 -башня гидратации; 12 - электрофильтр; 13 - вентилятор.
Более экономичный экстракционный
метод получения Ф. к. основан на разложении прир. фосфатов к-тами (в осн. серной,
в меньшей степени азотной и незначительно соляной). Фосфорнокислые р-ры, полученные
разложением азотной к-той, перерабатывают в комплексные удобрения, разложением
соляной к-той - в преципитат.
Сернокислотное разложение
фосфатного сырья [в странах СНГ гл. обр. хибинского апатитового концентрата
(см. Апатит)и фосфоритов Каратау] - осн. метод получения экстракционной
Ф. к., применяемой для произ-ва конц. фосфорных и комплексных удобрений. Суть
метода - извлечение (экстрагирование) P4O10 (обычно используют
ф-лу P2O5) в виде H3PO4. По этому
методу прир. фосфаты обрабатывают H2SO4 с послед, фильтрованием
полученной пульпы для отделения Ф. к. от осадка сульфата Ca. Часть выделенного
осн. фильтрата, а также весь фильтрат, полученный при промывке осадка на фильтре,
возвращают в процесс экстрагирования (р-р разбавления) для обеспечения достаточной
подвижности пульпы при ее перемешивании и транспортировке. Массовое соотношение
между жидкой и твердой фазами от 1,7 :1 до 3,0:1.
Прир. фосфаты разлагаются
по схеме:
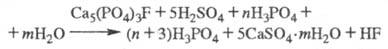
Разложению к-тами подвергаются
также сопутствующие примеси: кальцит, доломит, сидерит, нефелин, глауконит,
каолин и др. минералы. Это приводит к увеличению расхода используемой к-ты,
а также снижает извлечение P2O5 в целевой продукт вследствие
образования нерастворимых фосфатов железа FeH3(PO4)2·
2,5H2O при концентрациях P2O5 выше 40% (содержание
P4O10 обычно дается в пересчете на P2O5)
и FePO4· 2H2O - при более низких концентрациях. Выделяющийся
при разложении карбонатов СО2 образует в экстракторах стойкую пену;
р-римые фосфаты Mg, Fe и Al снижают активность Ф. к., а также уменьшают содержание
усвояемых форм P2O5 в удобрениях при послед. переработке
Ф. к.
С учетом влияния примесей
определены требования к фосфатному сырью, согласно к-рым прир. фосфаты с повышенным
содержанием соед. Fe, Al, Mg, карбонатов и орг. в-в непригодны для произ-ва
Ф. к.
В зависимости от т-ры и
концентрации Ф.к. в системе CaSO4-H3PO4-H2O
сульфат Ca осаждается в виде дигидрата (гипса), гемигидрата или ангидрита. В
реальных условиях осадок загрязнен примесями P2O5 в виде
неразложенных прир. фосфатов, недоотмытой H3PO4, сокристаллизованных
фосфатов разл. металлов и др., поэтому образующиеся сульфаты Ca наз. соотв.
фосфогипс, фосфогемигидрат и фосфо-ангидрит. В зависимости от типа осаждаемого
сульфата различают три прямых способа произ-ва экстракционной Ф. к.: дигидратный,
полугидратный (гемигидратный) и ангидрит-ный, а также комбинированные: полугидратно-дигидратный
и дигидратно-полугидратный.
В СНГ наиб. отработан в
пром-сти дигидратный способ, к-рый отличается высоким выходом P2O5
(93-96,5%) в продукционную к-ту; однако относительно низкая
концентрация Ф.к. требует ее послед. упаривания. Осн. стадии процесса: экстракция
с внеш. или внутр. циркуляцией и вакуумным или воздушным охлаждением экстракционной
пульпы, дозревание пульпы после экстрактора, отделение Ф. к. на наливных вакуум-фильтрах.
Эффективность процесса определяют в осн. экстрагирование P2O5
и фильтрование пульпы. Аппаратурное оформление должно обеспечить полноту разложения
сырья и кристаллизацию сульфата Ca в условиях миним. пересыщения им жидкой фазы.
Оптим. форма и размеры кристаллов сульфата Ca обусловливают хорошую фильтруемость
пульпы и эффективную отмывку от Ф.к. миним. кол-вом воды (для получения конц.
продукционной Ф.к.). Типовая схема дигидратного способа (рис. 4) реализуется
при непрерывном дозировании в экстрактор фосфатного сырья, 75-93%-ной H2SO4
и оборотной H3PO4. Т-ра процесса 72-75 0C,
продолжительность 4-6 ч. Использование 93%-ной H2SO4 (при
переработке апатитового концентрата) позволяет увеличить подачу воды для промывки
фосфогипса на вакуум-фильтре. Поступающая на фильтр Ф. к. отделяется, осадок
фосфогипса промывается на фильтре по противоточ-ной схеме водой с возвратом
образующейся слабой Ф.к. в экстрактор. Ф.к., полученную из апатитового концентрата
(28-32% P2O5), обычно упаривают до содержания P2O5
52-54%. Концентрирование Ф. к., полученной из фосфоритов (20-24% P2O5),
неосуществимо без предварит. очистки от примесей и не используется в пром-сти.
Гемигидратный процесс позволяет
получить более конц. Ф. к. (в отдельных случаях до 50% P2O5
без дополнит, упаривания). Ф.к., содержащую 36-38% P2O5,
можно получить из апатитового концентрата практически на том же оборудовании,
что и в типовом дигидратном процессе с воздушным охлаждением пульпы. Фосфориты
Каратау по этому методу не перерабатывают. Широкого распространения гемигидратные
процессы пока не получили из-за повышенной т-ры (80-100 0C), выделения
HF в газовую фазу, более низкого выхода P2O5 в к-ту, чем
в дигидратном методе. В усовершенствованных пром. схемах предусмотрено предварит.
смачивание апатитового сырья в скоростном смесителе, разделение зон разложения
и кристаллизации и др. Проведение процесса при содержании H2SO4
в жидкой фазе пульпы 0,2-1,0% в первом реакторе и 2,0-3,0% во втором позволяет
снизить кол-во растворенного сульфата Ca в продукционной Ф. к., значительно
уменьшить зарастание оборудования и трубопроводов, существенно интенсифицировать
работу осн. технол. узлов.
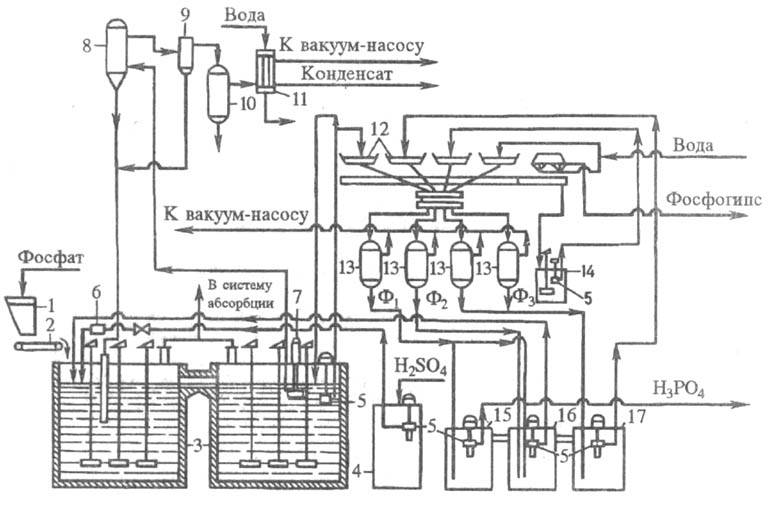
Рис. 4. Технологическая
схема типового произ-ва экстракционной H3PO4 в дигидратном
процессе из апатитового концентрата, мощность 110 тыс. т P2O5
в год: 1 - бункер для фосфатного сырья; 2 - ленточный весовой дозатор; 3 - двухбаковый
экстрактор; 4 -хранилище серной к-ты; 5 - погружной насос; 6 -расходомер серной
к-ты; 7 - циркуляционный погружной насос; 8 - испаритель; 9 - брызгоуловитель;
10 -барботажный нейтрализатор; 11 - конденсатор; 12 -лотки карусельного вакуум-фильтра;
13 - сепараторы (ресиверы); 14 - промежуточный сборник суспензии, образующейся
при регенерации фильтровальной ткани; 15, 16, 17 - барометрич. сборники: для
первого (основного) фильтра (15), для оборотной фосфорной к-ты (16), для промывного
фильтрата (17). Содержание P2O5 в фильтратах: Ф1
- 28-32%, Ф2 - 22-25%, Ф3 - 5-10% .
Ангидритный способ имеет
ряд преимуществ перед дигидратным и полугидратным: позволяет без упаривания
получать к-ту, содержащую до 50% P2O5; при экстракции
в газовую фазу выделяется большая часть фтора; получаемая к-та меньше загрязнена
сульфатом Ca. Использование метода в пром-сти сдерживают: жесткие коррозионные
условия (высокие т-ры и концентрации Ф. к.), образование мелких кристаллов и
необходимость большого числа ступеней противо-точной промывки.
Комбинированные способы
получения экстракционной Ф. к.- гемигидратно-дигидратный и дигидратно-гемигид-ратный
- более технологичны и экономичны, чем одностадийные. Обеспечивают повышение
степени использования фосфатного сырья (за счет снижения технол. потерь P2O5),
увеличение концентрации продукционной Ф. к., получение более чистого сульфата
Ca с целью его дальнейшей переработки.
За рубежом широко распространены
гемигидратно-дигид-ратные схемы, внедрен также дигидратно-гемигидратный способ.
Однако комбинир. процессы иногда усложнены двойным фильтрованием или нетехнологичны
из-за высокой продолжительности стадии перекристаллизации в гемигидратно-ди-гидратном
методе (общая продолжительность процесса 10-16 ч в зависимости от сырья). Из
усовершенствованных комбинир. технологий наиб. интерес представляет отечеств.
дигидратно-гемигидратный процесс с промежуточным фильтрованием. Метод позволяет
получать из апатитового концентрата Ф. к., содержащую 33-34% P2O5,
из фосфоритов Кара-тау - Ф. к., содержащую 28-30% P2O5.
Степень извлечения P2O5 из сырья ок. 99%. Продолжительность
процесса не превышает 6 ч. Фосфополугидрат (фосфогемигидрат) содержит менее
0,5% P2O5 и0,15% F и м.б. применен как вяжущее ср-во в
строит. материалах.
Термич. Ф. к. выпускается
85-86%-ная (по P2O5, свободна от примесей), экстракционная
- в виде 40%-ных водных р-ров (содержит много примесей).
Применение. Осн.
область использования Ф. к.- произ-во фосфорных и сложных конц. удобрений, а
также получение кормовых фосфатов, синтетич. моющих и водоумягчающих ср-в. В
металлообрабатывающей пром-сти Ф. к. применяют для фосфатирования, в текстильной
- для обработки и крашения шерсти, растит. и синтетич. волокон, в орг. синтезе
-как катализатор. Ф. к. и ее производные используют также для приготовления
буровых суспензий при нефтедобыче, в произ-ве разл. марок спец. стекла, в фотографии
(для произ-ва светочувствит. эмульсий), в медицине (приготовление медикаментов,
зубных цементов), при обработке древесины (для придания огнестойкости). Производные
Ф. к. применяют в пищ. пром-сти - от хлебопекарных порошков и приготовления
плавленых сыров до колбасного произ-ва и сахароварения.
Ф. к. при высоких концентрациях
вызывает ожоги, пары -атрофич. процессы в слизистой носа, носовые кровотечения,
крошение зубов, изменение ф-лы крови и др.; ЛД50 1,25 г/кг (внутрижелудочно),
JIK50 25,5 кг/м3 (ингаляция) -для мышей и крыс.
Лит.: Термическая
фосфорная кислота, соли и удобрения на ее основе, под ред. H.H. Постникова,
M., 1976; Лурье Ю.Ю., Справочник по аналитической химии, 5 изд., M., 1979; Технология
фосфора, под ред. В. А. Ершова, В. H. Белова, Л,, 1979; Переработка фосфора,
Л., 1985; Технология фосфорных и комплексных удобрений, под ред. С. Д. Эвенчика,
А. А. Бродского, M., 1987; Кислотные методы переработки фосфатного сырья, M.,
1988.
H. В. Букколини.