ФОСФОДИЭСТЕРАЗЫ циклических
3', 5'-нукле-о т ид о в (3',5'-циклонуклеотид 5'-нуклеотидгидролазы), ферменты
класса гидролаз, катализирующие гидролиз циклич. 3', 5'-аденозин- и 3', 5'-гуанозинмонофосфатов,
а также нек-рых др. циклич. нуклеотидов в присут. Mg2+:

Ф. присутствуют практически
во всех исследованных тканях, а также в клетках бактерий. Функционирование Ф.
обусловливает снижение внутриклеточной концентрации циклич. нуклеотидов, в частности,
после гормональной стимуляции аденилатциклазы. Ф. могут также участвовать
во внутриклеточной передаче сигнала.
Известно большое кол-во
изоферментов Ф., различающихся по структуре, ферментативной активности, субстратной
специфичности и зависимости от коферментов. По последним двум св-вам их делят
на 4 осн. группы: Са2+-кальмоду-линзависимые, цГМФ-модулируемые,
цАМФ- и цГМФ-спе-цифичные (цАМФ и цГМФ - соотв. циклич. аденозинмоно-фосфат
и циклич. гуанозинмонофосфат).
Ф. первой группы присутствуют
в сердечной мышце и в мозговой ткани. Их активность значительно возрастает в
присут. Ca2+.
Ф. второй группы широко
распространены в тканях нервной системы, в корковом в-ве надпочечников, где
они, возможно, участвуют в регуляции биосинтеза стероидных гормонов. цГМФ обычно
увеличивает скорость гидролиза ферментом цАМФ. В сердечной мышце, в нек-рых
типах гладкой мускулатуры, в тромбоцитах, жировых клетках и гепатоцитах присутствуют
Ф. этой группы, к-рые ингибируются цГМФ.
Ф. третьей группы обнаружены
в половой системе, где их экспрессия может индуцироваться цАМФ в нервной ткани,
в почках и лимфоцитах. У дрозофилы показана центральная роль Ф. этой группы
в биохим. механизмах, определяющих поведенческие р-ции.
Ф. четвертой группы присутствуют
в легких и тромбоцитах, а также в клетках палочек и колбочек сетчатки. Наиб,
изучена Ф. из клеток палочек сетчатки. Она участвует в передаче зрительного
сигнала. Этот фермент состоит из трех субъединиц - двух гомологичных каталитич.
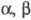 -субъединиц
(мол. м. 90 тыс., рI 5,3) и
-субъединиц
(мол. м. 90 тыс., рI 5,3) и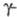 субъединицы
(мол. м. 10 тыс., рI 10,5). Первичная структура всех трех субъединиц
известна. В результате активации Ф. светом происходит освобождение
субъединицы
(мол. м. 10 тыс., рI 10,5). Первичная структура всех трех субъединиц
известна. В результате активации Ф. светом происходит освобождение 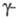 субъединицы из комплекса холофермента, При этом скорость гидролиза цГМФ возрастает
приблизительно в 100 раз, что ведет к падению локальной внутриклеточной концентрации
цГМФ, закрытию катионных каналов на мембране и гиперполяризации клеток (см.
Родопсин).
субъединицы из комплекса холофермента, При этом скорость гидролиза цГМФ возрастает
приблизительно в 100 раз, что ведет к падению локальной внутриклеточной концентрации
цГМФ, закрытию катионных каналов на мембране и гиперполяризации клеток (см.
Родопсин).
Конкурентные ингибиторы
Ф. всех типов - теофиллин, папаверин и З-изобутил-1-метилксантин.
Лит.: Beavo J. А.,
Reifsnyder D.H., "Trends in Pharm. Sci.", 1990, v. 11, p. 150-55.
B. M. Липкин, M. Ю. Натонин.


