ФОСФАТЫ КОНДЕНСИРОВАННЫЕ,
соли конденсированных фосфорных K-T (см. Фосфора кислоты, Фосфаты неорганические),
в к-рых степень окисления фосфора +5. Подобно к-там образуют гомологич.
ряды с цепочечным, циклич. и разветвленным строением аниона. Построены из тетраэдров
PO4, связанных общими кислородными вершинами. Получены в аморфном,
стеклообразном и кристаллич. виде. Способность к кристаллизации меняется в зависимости
от мол. м. аниона. Так, в ряду цепочечных фосфатов (Ф.)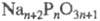 моно- (п=1)и дифосфат (п = 2) кристаллизуются легко и
аморфное состояние для них нехарактерно; трифосфат (n = 3) м. б. получен
в кристаллич., высоковязком и стеклообразном состояниях, средние члены ряда
не кристаллизуются, а высокомол. соед. образуют неск. кристаллич. модификаций.
Такая закономерность объясняется на основе теории перестройки цепей Ван Везера:
при больших n разница между св-вами
цепей разл. длины нивелируется и фосфатные смеси ведут себя подобно индивидуальным
солям с n = 1-3, способным кристаллизоваться.
моно- (п=1)и дифосфат (п = 2) кристаллизуются легко и
аморфное состояние для них нехарактерно; трифосфат (n = 3) м. б. получен
в кристаллич., высоковязком и стеклообразном состояниях, средние члены ряда
не кристаллизуются, а высокомол. соед. образуют неск. кристаллич. модификаций.
Такая закономерность объясняется на основе теории перестройки цепей Ван Везера:
при больших n разница между св-вами
цепей разл. длины нивелируется и фосфатные смеси ведут себя подобно индивидуальным
солям с n = 1-3, способным кристаллизоваться.
Цепочечные Ф. (п о л и
ф о с ф а т ы). Анионы полифосфатов построены в виде цепей:
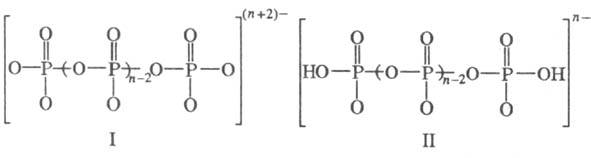
При n > 3
цепь содержит две концевые и переменное кол-во срединных групп PO4,
ф-ла 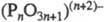 (I) соответствует коротким цепям, ф-ла
(I) соответствует коротким цепям, ф-ла 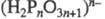 (П) - длинным цепям
(П) - длинным цепям 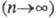 , на концах к-рых имеются группы ОН. Условно ряд делят на 3 группы: олигофосфаты
(n< 30-35), к-рые м. б. разделены методом ионообменной хроматографии
и отделены от соед. P в степенях окисления от +1 до +4, при малых п кристаллизуются;
среднемол. Ф. (30-35 < п < 100-200) - некристаллизующиеся смеси,
м. б. разделены на фракции, к-рые характеризуются средней длиной цепи т, средней
мол. массой, видом ф-ции MMP анионов; высокомол. Ф. (п > 102-103)
образуют аналогичные фракции, нек-рые кристаллизуются. Индивидуальные Ф. обозначают
Pn, смесевые фракции - Рт. Известно не менее
6 типов цепочек анионов высокомол. средних Ф.
, на концах к-рых имеются группы ОН. Условно ряд делят на 3 группы: олигофосфаты
(n< 30-35), к-рые м. б. разделены методом ионообменной хроматографии
и отделены от соед. P в степенях окисления от +1 до +4, при малых п кристаллизуются;
среднемол. Ф. (30-35 < п < 100-200) - некристаллизующиеся смеси,
м. б. разделены на фракции, к-рые характеризуются средней длиной цепи т, средней
мол. массой, видом ф-ции MMP анионов; высокомол. Ф. (п > 102-103)
образуют аналогичные фракции, нек-рые кристаллизуются. Индивидуальные Ф. обозначают
Pn, смесевые фракции - Рт. Известно не менее
6 типов цепочек анионов высокомол. средних Ф. 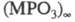 (рис. 1, a-e). B солях Rb и Cs (a), Li (низкотемпературная форма)
и К (б) двучленные цепи содержат повторяющуюся структурную единицу, состоящую
из двух тетраэдров PO4. Цепи анионов соли Na и высокотемпературной
соли Маддрелла (в, см. Натрия фосфаты)являются трехчленными,
а солей Pb и Ca (г) - четырехчленными. У серебряной и натриевой соли
Курроля-А (д)и натриевой соли Курроля- В (е)цепи завиваются
в спираль по-разному.
(рис. 1, a-e). B солях Rb и Cs (a), Li (низкотемпературная форма)
и К (б) двучленные цепи содержат повторяющуюся структурную единицу, состоящую
из двух тетраэдров PO4. Цепи анионов соли Na и высокотемпературной
соли Маддрелла (в, см. Натрия фосфаты)являются трехчленными,
а солей Pb и Ca (г) - четырехчленными. У серебряной и натриевой соли
Курроля-А (д)и натриевой соли Курроля- В (е)цепи завиваются
в спираль по-разному.
При плавлении, переходе
в аморфное состояние, образовании вязкой массы индивидуальные полифосфаты превращаются
в смесевые фракции (Pn Pm).
В воде раств. лишь полифосфаты щелочных металлов. В водных р-рах фосфаты
Pn и Рm нестабильны и разлагаются до ортофосфатов,
р-ция ускоряется при нагр., понижении рН, добавлении ферментов и комплексообразователей.
Полифосфаты - типичные полиэлектролиты, с ионами металлов образуют раств. в
воде комплексы, Ф. с длинными цепями коагулируют белок.
Pm).
В воде раств. лишь полифосфаты щелочных металлов. В водных р-рах фосфаты
Pn и Рm нестабильны и разлагаются до ортофосфатов,
р-ция ускоряется при нагр., понижении рН, добавлении ферментов и комплексообразователей.
Полифосфаты - типичные полиэлектролиты, с ионами металлов образуют раств. в
воде комплексы, Ф. с длинными цепями коагулируют белок.
Получают цепочечные Ф.
дегидратацией кислых ортофосфатов при определенных режимах нагревания и охлаждения.
Применяют в произ-ве фосфатных стекол, моющих ср-в, как пептизирующие и флокулирующие
реактивы, ионообменные смолы и др.
Ф. с п = 2 (д и
фосфаты, п и ро фосфаты) - соли пирофосфорной к-ты H4P2O7.
Эти соед. принято включать в ряд конденсированных Ф. условно, т. к. их анион
P2O4-7 не содержит срединной группы PO4;
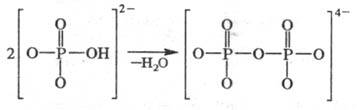
по св-вам заметно отличаются от Ф. с п > 2. Обычно пирофосфаты получают
твердо-фазной конденсацией гидрофосфатов:
Ф. с n = 3(трифосфаты)
способны удерживать в р-ре ионы тяжелых металлов, стабилизировать коллоидные
системы, усиливать действие моющих ср-в и др. Триполифосфат натрия Na5P3O10
- промежут. продукт в синтезе моющих средств; гексагидрат образует кристаллы.
Плавление, высали-вание из р-ра, мех. активация и др. виды обработки, вызывающие
переход Pn Рт,
приводят к изменению во времени ф-ции MMP.
Рт,
приводят к изменению во времени ф-ции MMP.
Ф. с n = 4 (т е
т r а ф о с ф а т ы). Хорошо изучен тетрафос-фат Na4H2P4O13;
он не кристаллизуется из водного р-ра, при упаривании р-ра образует вязкую массу.
Получены немногие кристаллич. соли - раств. в воде тетрафосфаты аммония, гуанидиния,
акридиния, не раств. в воде соли Ba, Bi, Pb(II).
Ф. с 5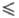 п
< 30-35. Разделяются методами хроматографии и электрофореза, нек-рые
низшие соли получены препаратив-но. Известны кристаллич. соед. Na3Mg2P5O16,
Ca4P6O19, [Co(NH3)6]8(P6019)2·
2H20.
п
< 30-35. Разделяются методами хроматографии и электрофореза, нек-рые
низшие соли получены препаратив-но. Известны кристаллич. соед. Na3Mg2P5O16,
Ca4P6O19, [Co(NH3)6]8(P6019)2·
2H20.
Ф. с п > 30-35.
По мере увеличения п(т)и уменьшения величины R — MI2O:
P2O5 = MI: P 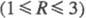 фосфатные смеси обогащаются высш. компонентами, нек-рые из них образуют по неск.
кристаллич. модификаций. Так, высокомол. Ф. аммония образует до 5 кристаллич.
форм. В пром-сти выпускают стеклообразные Ф. натрия ("гексаметафосфат",
"кал-гон"), используемые как умягчители воды, компоненты моющих
ср-в и буровых р-ров.
фосфатные смеси обогащаются высш. компонентами, нек-рые из них образуют по неск.
кристаллич. модификаций. Так, высокомол. Ф. аммония образует до 5 кристаллич.
форм. В пром-сти выпускают стеклообразные Ф. натрия ("гексаметафосфат",
"кал-гон"), используемые как умягчители воды, компоненты моющих
ср-в и буровых р-ров.
Циклические Ф. (метафосфаты).
Эти соед.- соли метафосфорных к-т (HPO3)х, где
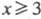 .Содержат
циклич. анион (PO3)х-х. Неустойчивые
анионы PO-3 (х= 1) м. б. стабилизированы в результате
присоединения орг. радикалов, они образуются в нек-рых высокотемпературных процессах
и р-циях фосфорилирования. Низшие члены гомологич. ряда циклофосфатов Px
имеют состав
.Содержат
циклич. анион (PO3)х-х. Неустойчивые
анионы PO-3 (х= 1) м. б. стабилизированы в результате
присоединения орг. радикалов, они образуются в нек-рых высокотемпературных процессах
и р-циях фосфорилирования. Низшие члены гомологич. ряда циклофосфатов Px
имеют состав 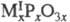 (3
(3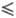 х<
12-15), их отделяют друг от друга и от полифосфатов методами хроматографии
и электрофореза. Метафосфаты - кристаллич. или стеклообразные соед., при прокаливании
отщепляют P2O5 и переходят в пиро-, а затем в ортофосфаты,
напр.:
х<
12-15), их отделяют друг от друга и от полифосфатов методами хроматографии
и электрофореза. Метафосфаты - кристаллич. или стеклообразные соед., при прокаливании
отщепляют P2O5 и переходят в пиро-, а затем в ортофосфаты,
напр.:
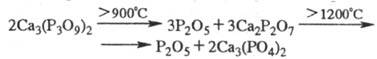
Метафосфаты щелочных металлов
и аммония хорошо раств. в воде, соли Ca, Al, Cu - плохо. В нейтральных водных
р-рах при 25 0C стабильны, в щелочных р-рах быстро разлагаются из-за
размыкания цикла. Получают метафосфаты из ортофосфатов при нагр. или взаимод.
P2O5 с карбонатами металлов.
Ф. с х=3 (трициклофосфаты).
Образование три-мера можно представить как замыкание цепочки дигидротри-фосфата
в кольцо P3:
В присут. уксусного ангидрида
процессы циклизации - де-циклизации протекают обратимо:  Средняя длина связи P — O в кольце для Na3P3O9
0,1615 нм, вне кольца
- 0,1484 нм, углы OPO и POP в кольце равны соотв. 101,1 и 126,9°.
Средняя длина связи P — O в кольце для Na3P3O9
0,1615 нм, вне кольца
- 0,1484 нм, углы OPO и POP в кольце равны соотв. 101,1 и 126,9°.
Ф. с х = 4(тетрациклофосфаты).
Кольцо P4 может принимать конформации типа "кресла" и
"ванны". Для солей Na и аммония длина связи Р — О в кольце 0,147-0,165
нм, угол OPO 101-124°, POP 130-131°. Конфигурации кольца P4 разл.
Ф. представлены на рис. 2.
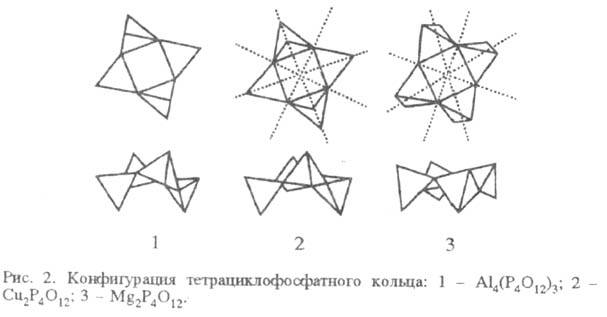
Ф. с 5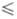 х
< 12-15. Известны пента-, гекса-, гепта- и октациклофосфаты щелочных металлов
и их кристаллогидраты - Na5P5O15·4H2O,
MI6P6O18·6H2O, где M
= Li, Na,
х
< 12-15. Известны пента-, гекса-, гепта- и октациклофосфаты щелочных металлов
и их кристаллогидраты - Na5P5O15·4H2O,
MI6P6O18·6H2O, где M
= Li, Na, 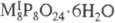 , где M = Na, К. Термич. св-ва кристаллич. Na6P6O18·6H2O
и Na3P3O9·6H2O сходны - при нагр.
они превращаются в безводные соли без разрыва кольца.
, где M = Na, К. Термич. св-ва кристаллич. Na6P6O18·6H2O
и Na3P3O9·6H2O сходны - при нагр.
они превращаются в безводные соли без разрыва кольца.
Вопрос о существовании
макроциклов с х =12-15 не решен. Состав высокомол. цепочечных и циклич.
Ф. практически не различим. Методом рентгеноструктурного анализа обнаружен циклич.
анион P12O12-36 в семействе метафосфатов Al,
Fe, Cr, V, Ga.
Ультрафосфаты (изополифосфаты,
изомета-фос фаты). Имеют разветвленное строение анионов (0<R< I),
в к-рых по крайней мере неск. тетраэдров PO4 имеют три общих вершинных
атома О. При уменьшении R, начиная с R=1, число точек разветвления
увеличивается и сравнительно простые комбинации цепей и колец или разветвленных
цепей, встречающиеся у изомеров низших Рn и Px,
сменяются более сложными вплоть до образования характерной для P2O5
плотной сетчатой структуры. Вследствие существования трехсвязанных тетраэдров
PO4 (точек разветвления) ультрафосфаты неустойчивы. В противоположность
Ф., содержащим только двухсвязанные тетраэдры, при контакте с влагой быстро
разлагаются по точкам разветвления с образованием поли- и метафосфатов. Плохо
раств. в воде.
Известны стеклообразные
ультрафосфаты, а также кристаллич. состава 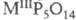 , где M - РЗЭ и Bi и
, где M - РЗЭ и Bi и 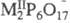 и
и 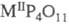 , где
M - Ca, Со, Mn, Cd,
, где
M - Ca, Со, Mn, Cd, 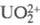 .
Структуры типа ультрафосфатов встречаются в стеклах, расплавах, вязких и аморфных
в-вах, образующихся при взаимод. P2O5 с H2O,
фосфатами, солями и оксидами металлов при соотношении
.
Структуры типа ультрафосфатов встречаются в стеклах, расплавах, вязких и аморфных
в-вах, образующихся при взаимод. P2O5 с H2O,
фосфатами, солями и оксидами металлов при соотношении 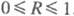 . Кристаллич. ультрафосфаты - лазерные материалы с низким порогом возбуждения.
. Кристаллич. ультрафосфаты - лазерные материалы с низким порогом возбуждения.
Лит.: Ван Везер
Д ж., Фосфор и его соединения, пер. с англ., M., 1962, с. 462-548; Продан Е.А.,
Продан Л. И., Ермоленко H. Ф., Триполи-фосфаты и их применение, Минск, 1969,
с. 5-49, 160-238; Кузьм ен-ков M. И., Печковский В.В., Плышевский С. В., Химия
и технология метафосфатов, Минск, 1985, с. 25-64; Продан E.А., Топохимия кристаллов,
Минск, 1990, с. 169-88. E. А. Продан.


