ФИНКЕЛЬШТАЙНА РЕАКЦИЯ
(Конанта - Финкель-штайна р-ция), замещение хлора или брома в орг. соед.
на иод при действии иодидов металлов:

Наиб. легко в Ф.р. вступают
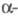 галогенкарбонильные
соед., аллил- и бензилгалогениды. Легкость обмена галогенами уменьшается в ряду
алкилгалогенидов: первичные > вторичные > третичные. Бромиды обычно более
реакционноспособны, чем хлориды. Обмен галогена в ароматич. кольце возможен
лишь при наличии электроноакцепторного заместителя. Винилброми-ды дают удовлетворит,
выходы иодидов при действии KI в присут. катализатора - смеси NiBr2
с цинком.
галогенкарбонильные
соед., аллил- и бензилгалогениды. Легкость обмена галогенами уменьшается в ряду
алкилгалогенидов: первичные > вторичные > третичные. Бромиды обычно более
реакционноспособны, чем хлориды. Обмен галогена в ароматич. кольце возможен
лишь при наличии электроноакцепторного заместителя. Винилброми-ды дают удовлетворит,
выходы иодидов при действии KI в присут. катализатора - смеси NiBr2
с цинком.
Р-цию проводят в р-рителе
(ацетоне, метилэтилкетоне, H2O, CH3OH); чаще используют
ацетон, обеспечивающий р-римость наиб, часто используемого иодирующего агента
NaI и выведение из р-ции (выпадение в осадок) NaCl или NaBr, что смещает равновесие
р-ции в сторону образования RI.
Обычно смесь иодида металла
и RHal в р-рителе кипятят с обратным холодильником до прекращения выпадения
осадка хлорида или бромида металла [напр., при получении (CH3)3CCH2I
из бромида и NaI - 48 ч]. Выходы колеблются в широких пределах; в случае реакционноспособных
орга-нилбромидов они составляют 80-90%, при использовании третичных алкилхлоридов
- 20-40% (выход повышается при проведении р-ции в присут. ZnCl2 в
среде CS2).
Осн. побочные продукты
- олефины (результат дегидрога-логенирования RHaI), а также спирты и простые
эфиры.
По механизму Ф. р.- типичное
бимол. нуклеоф. замещение (SN2), сопровождающееся обращением конфигурации.
Ф.р. используют в препаративной
практике для синтеза орг. иодидов, к-рые трудно или невозможно получить др.
способами (напр., непосредственным иодированием), а также в аналит. химии -
для качеств. обнаружения орг. хлоридов и бромидов.
Р-ция открыта Г. Финкельштайном
в 1910.
Лит.: Шрайнер Р.,
Фьюзон Р., Систематический качественный анализ органических соединений, пер.
с англ., M., 1950; Treib s W. [u. a.], "Chem. Вег.", 1960, Bd 93,
№ 10, S. 2198-208. Г.И. Дрозд.


