ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых
макромолекул, называемых ферментами (энзимами). Ф.к.- разновидность катализа,
хотя термин "ферментация" (брожение)известен с давних времен, когда
еще не было понятия хим. катализа.
Первое исследование Ф.
к. как хим. процесса было выполнено К. Кирхгофом, к-рый в 1814 продемонстрировал
фер-ментативную конверсию крахмала в растворимые углеводы.
Заметный вклад в представление
о природе Ф. к. внесли работы И. Берцелиуса и Э. Мичерлиха, к-рые включили ферментативные
р-ции в категорию хим. каталитич. процессов. В кон. 19 в. Э. Фишер высказал
гипотезу о специфичности ферментативных р-ций и тесном стерич. соответствии
между субстратом и активным центром фермента. Основы кинетики ферментативных
р-ций были заложены в работах Л. Михаэ-лиса (1913).
В 20 в. происходит интенсивное
изучение хим. основ Ф. к., получение ферментов в кристаллич. состоянии, изучение
структуры белковых молекул и их активных центров, исследование большого числа
конкретных ферментативных р-ций и ферментов.
В простейшем случае ур-ние
р-ции с участием фермента имеет вид:
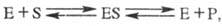
где E - фермент, S - субстрат,
ES - фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт р-ции.
Превращение субстрата в
продукт происходит в комплексе Михаэлиса. Часто субстрат образует ковалентные
связи с функц. группами активного центра, в т. ч. и с группами кофермента (см.
Коферменты). Большое значение в механизмах ферментативных р-ций имеет
основной и кислотный катализ, реализуемый благодаря наличию имидазольных групп
остатков гистидина и карбоксильных групп дикарбоно-вых аминокислот.
Важнейшие особенности Ф.
к.- эффективность, специфичность и чувствительность к регуляторным воздействиям.
Ферменты увеличивают скорость хим. превращения субстрата по сравнению с неферментативной
р-цией в 109-1012 раз. Столь высокая эффективность обусловлена
особенностями строения активного центра. Принято считать, что активный центр
комплементарен (см. Комплементарность)переходному состоянию субстрата
при превращении его в продукт. Благодаря этому стабилизируется переходное состояние
и понижается активац. барьер р-ции.
Большинство ферментов обладает
высокой субстратной специфичностью, т. е. способностью катализировать превращение
только одного или неск. близких по структуре в-в. Специфичность определяется
топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется
в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, к-рые
катализируют идентичные р-ции, но отличаются строением и каталитич. св-вами),
а также условиями среды (рН, т-ра, ионная
сила р-ра) и многочисленными ингибиторами и активаторами, присутствующими в
организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных
концентрациях), продукты р-ции, а также конечные продукты в цепи последоват.
превращений в-ва (см. Регуляторы ферментов).
Ферментативные р-ции чувствительны
к внеш. условиям, в частности к ионной силе р-ра и рН среды. Влияние т-ры на
скорость ферментативной р-ции описывается кривой с максимумом, восходящая ветвь
к-рой отражает обычную для хим. р-ций зависимость, выраженную ур-нием Аррениуса.
Нисходящая ветвь связана с тепловой денатурацией фермента. Максимум кривой соответствует
оптимальной т-ре Tопт, значение к-рой для большинства ферментов
лежит в пределах 40-50 0C. Для нек-рых ферментов, особенно ферментов
термофильных микроорганизмов, Tопт 80-90 0C. Подробнее
о кинетике ферментативных р-ций см. Ферментативных реакций кинетика.
Осн. направления совр.
исследований Ф.к.- выяснение механизма, обусловливающего высокие скорости процессов,
высокую селективность (специфичность действия ферментов), изучение механизмов
контроля и регуляции активности ферментов. Оказалось, в частности, что р-ции
Ф. к. включают большое число стадий с участием лабильных промежут. соед., времена
жизни к-рых изменяются в нано- и миллисекундном диапазонах. На активных центрах
ферментов протекают быстрые (нелимитирующие) стадии, в результате чего понижается
энергетич. барьер для наиб. трудной, лимитирующей стадии.
Установлен механизм регулирования
ферментативной активности путем действия ингибитора (или активатора) на специфичный
центр белковой молекулы с опосредованной передачей воздействия на активный центр
фермента через белок. Обнаружены эффекты кооперативного взаимод. неск. молекул
субстрата на белковой матрице. Найден способ "жесткого" выведения
фермента из процесса посредством индуцированной субстратом необратимой инактивации.
Ф. к.- основа мн. современных
хим. технологий, в частности крупномасштабных процессов получения глюкозы и
фруктозы, антибиотиков, аминокислот, витаминов и регуляторов, а также тонкого
орг. синтеза. Разработаны методы, позволяющие проводить ферментативные р-ции
в орг. р-ри-телях, обращенных мицеллах (см. Мицеллообразование). С Ф.к.
связаны перспективы развития иммуноферментного и биолюминесцентного анализа,
применения биосенсоров. Созданы методы, позволившие придать каталитич. активность
антителам, обнаружена каталитич. активность у рибонуклеи-новой к-ты (абзимы,
рибозимы соотв.).
Лит.: Б е r
е з и н И. В., Исследования в области ферментативного катализа и инженерной
этимологии, M., 1990. См. также лит. к ст. Биотехнология^ Генетическая инженерия,
Ферментативных реакций кинетика, Ферменты.
С. Д. Варфоломеев.


