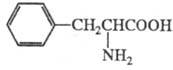
ФЕНИЛАЛАНИН (2-амино-З-фенилпропионовая
к-та, b-фенил-a-аланин, Phe, F), мол. м. 165,19; бесцв. кристаллы, т. пл.
D, L-, D- и L-F. соотв. 271-273, 285 и 283 0C (все плавятся
с разложением); сублимируется в вакууме; для D-F. 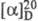 +7,1° (концентрация 3,8 г в 100 мл 18% HCl), для L-F.
+7,1° (концентрация 3,8 г в 100 мл 18% HCl), для L-F. 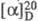 -35,1° (концентрация 1,94 г в 100 мл воды); ограниченно раств. в
воде, плохо - в этаноле. При 25 0C рКа 2,58 (COOH)
и 9,24 (NH2); рI 5,91. D-F. имеет сладкий вкус, L-F.-
слегка горьковатый.
-35,1° (концентрация 1,94 г в 100 мл воды); ограниченно раств. в
воде, плохо - в этаноле. При 25 0C рКа 2,58 (COOH)
и 9,24 (NH2); рI 5,91. D-F. имеет сладкий вкус, L-F.-
слегка горьковатый.
Ф.- ароматич. 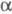 -аминокислота,
дает ксантопротеиновую реакиию, м. б. осажден из водного р-ра 2,5-дибромбензол-сульфокислотой.
При нагревании Ф. декарбоксилируется с образованием 2-фенилэтиламина; нитрованием
Ф. может быть получен 4-нитрофенилаланин.
-аминокислота,
дает ксантопротеиновую реакиию, м. б. осажден из водного р-ра 2,5-дибромбензол-сульфокислотой.
При нагревании Ф. декарбоксилируется с образованием 2-фенилэтиламина; нитрованием
Ф. может быть получен 4-нитрофенилаланин.
L-F.- кодируемая,
незаменимая аминокислота, встречается во всех организмах в составе молекул белков,
напр, в оваль-бумине, зеине, фибрине, инсулине, гемоглобине; входит в состав
пептидов-подсластителей (см. Аспартам), соматоста-тина и энкефалина.
Остаток D-F. входит в грамицидин S и нек-рые др. пептиды.
Биосинтез L-F. осуществляется
из эритрозо-4-фосфата и фосфоенолпирувата через шикимовую, префеновую (см. Обмен
веществ)и фенилпировиноградную к-ты.
В организме под действием
фермента фенилаланин - 4-мо-нооксигеназы Ф. превращается в тирозин. При
отсутствии или резком снижении активности фермента возникает заболевание фенилкетонурия,
к-рое проявляется гл. обр. выраженной олигофренией.
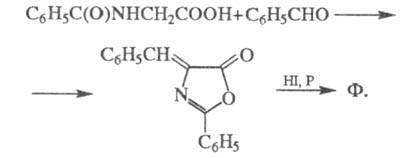
Синтезируют Ф. из малонового
эфира и бензилхлорида, а также из гиппуровой к-ты и бензальдегида через азлактон:
В УФ спектре Ф. 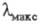 257,4 нм,
257,4 нм, 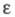 1,97·102, в спектре флуоресценции Ф.
1,97·102, в спектре флуоресценции Ф.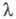 испускания
282 нм. В спектре ПМР L-F. в D2O величины хим. сдвигов протонов
(в м.д.) у
испускания
282 нм. В спектре ПМР L-F. в D2O величины хим. сдвигов протонов
(в м.д.) у 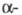 и
и 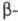 атомов С цепи соотв. 3,993 и 3,292, 3,127.
атомов С цепи соотв. 3,993 и 3,292, 3,127.
L-F. впервые выделили
из ростков люпина Э. Шульце и И. Барбиери в 1881.
Мировое произ-во L-F. ок. 150 т в год (1982). В. В. Боев.


