ФАРМАКОКИНЕТИКА (от
греч. pharmakon - лекарство и kinetikos - приводящий в движение), изучает кинетич.
закономерности процессов, происходящих с лек. ср-вом в организме. Осн. фармакокинетич.
процессы: всасывание, распределение, метаболизм и экскреция (выведение).
Основы Ф. создавались учеными
разных специальностей в разл. странах. В 1913 нем. биохимики Л. Михаэлис и M.
Ментен предложили ур-ние кинетики ферментативных процессов, широко используемое
в современной Ф. для описания метаболизма лек. ср-в (см. Ферментативных реакций
кинетика). Швед, физиолога Э. Видмарк, Д. Тандберг (1924) и T. Теорелл (1937)
применяли системы дифференциальных ур-ний при анализе разл. способов введения
лек. ср-в. Амер. физиолог В. Гамильтон и другие (1931) использовали метод статистич.
моментов для оценки параметров Ф. по эксперим. данным. Основы метаболизма лек.
ср-в были заложены англ, биохимиками X. Бреем, В. Торпом и К. Уайтом (1951).
Практич. аспекты применения Ф. для оптимизации фармако-терапии разрабатывали
К. Лапп во Франции (1948-56), А. ван Гемерт и др. в Дании (1950), Э. Крюгер-Тиммер
(I960) и Ф. Дост (1953-68) в Германии (последний - автор термина "Ф.").
Развитие Ф. до нач. 50-х
гг. 20 в. сдерживалось отсутствием высокочувствит. и селективных методов анализа
микроконцентраций лек. B-B в биол. средах и недостаточной компьютеризацией исследований.
С решением этих проблем Ф. получила дальнейшее развитие. В России развитие Ф.
началось в 60-х гг. и связано с именами В. А. Филова, В. H. Соловьева и В. П.
Яковлева.
Ф. содействует решению
проблемы эффективности и безопасности фармакотерапии путем исследования зависимости
терапевтич., токсич. и побочных эффектов лек. ср-в от их концентраций в месте
действия или в анализируемой биол. среде (чаще всего в крови) и расчету оптим.
режимов введения препаратов для создания и поддержания оптим. концентраций лек.
B-B.
Для определения микроконцентраций
лек. B-B и продуктов их метаболизма используют хроматографию, спектральные,
иммунохим., радиоизотопные и др. методы.
Всасывание. Во всех
случаях, когда лек. ср-во вводится не в сосудистое русло, оно попадает в кровь
путем всасывания; в случае твердой формы сначала происходит растворение (высвобождение),
а затем молекулы лек. в-ва проникают в системный кровоток, чаще всего путем
простой диффузии из места введения, а иногда с помощью активного транспорта.
T. наз. пролонгированные (ретардированные) лек. формы обеспечивают
медленное, контролируемое поступление лек. в-ва в организм.
При приеме внутрь лек.
в-ва основного характера (амины) всасываются обычно в тонком кишечнике (сублингвальные
лек. формы всасываются из ротовой полости, ректальные -из прямой кишки), лек.
в-ва нейтрального или кислого характера начинают всасываться уже в желудке.
Всасывание характеризуется
скоростью и степенью всасывания (т. наз. биодоступностью). Степень всасывания
- кол-во лек. в-ва (в % или в долях), к-рое попадает в кровь при разл. способах
введения. На всасывание сильно влияют лек. форма, а также др. факторы. При приеме
внутрь многие лек. в-ва в процессе всасывания под действием ферментов печени
(или к-ты желудочного сока) биотранс формируются в метаболиты, в результате
чего лишь часть лек. в-в достигает кровяного русла. Степень всасывания лек.
в-ва из желудочно-кишечного тракта, как правило, снижается при приеме лекарства
после еды.
Влияние лек. форм на всасывание,
пути и способы введения лек. ср-в изучает спец. раздел Ф.- "биофармация".
Распределение по органам
и тканям. В организме лек. в-во распределяется между кровью, межклеточной
жидкостью и клетками тканей. Распределение зависит от относит. сродства молекул
лек. в-ва к биомакромолекулам крови и тканей. Необходимое условие реализации
фармакологич. действия лек. в-ва - его проникновение в ткани-мишени; напротив,
попадание лек. в-ва в индифферентные ткани снижает действующую концентрацию
и может привести к нежелат. побочным эффектам (напр., к канцерогенезу).
Для количеств, оценки распределения
дозу лек. в-ва делят на его начальную концентрацию в крови (плазме, сыворотке),
экстраполированную к моменту введения, или используют метод статистич. моментов.
Получают условную величину объема распределения (объем жидкости, в к-ром нужно
растворить дозу, чтобы получить концентрацию, равную кажущейся начальной концентрации).
Для нек-рых водорастворимых лек. в-в величина объема распределения может принимать
реальные значения, соответствующие объему крови, внеклеточной жидкости или всей
водной фазы организма. Для жирорастворимых лек. ср-в эти оценки могут превышать
на 1-2 порядка реальный объем организма благодаря избират. кумуляции лек. в-ва
жировыми и др. тканями.
Метаболизм. Лек.
в-ва выделяются из организма либо в неизмененном виде, либо в виде продуктов
их биохим. превращений (метаболитов). При метаболизме наиб. распространены процессы
окисления, восстановления, гидролиза, а также соединение (конъюгация) с остатками
глюкуроновой, серной, уксусной к-т. Метаболиты, как правило, более поляр-ны
и лучше растворимы в воде по сравнению с исходным лек. в-вом, поэтому быстрее
выводятся с мочой. Метаболизм может протекать спонтанно, но чаще всего катализируется
ферментами (напр., цитохромами), локализованными в мембранах клеток и клеточных
органелл печени, почек, легких, кожи, мозга и др.; нек-рые ферменты локализованы
в цитоплазме. Биол. значение метаболич. превращений - подготовка липорастворимых
лек. ср-в к выведению из организма.
Экскреция. Лек.
в-ва выводятся из организма с мочой, калом, потом, слюной, молоком, с выдыхаемым
воздухом. Выведение зависит от скорости доставки лек. в-ва в выделит. орган
с кровью и от активности собственно выделит. систем. Водорастворимые лек. в-ва
выводятся, как правило, через почки. Этот процесс определяется алгебраич.
суммой трех осн. процессов: гломерулярной (клубочковой) фильтрации, канальцевой
секреции и реабсорбции. Скорость фильтрации прямо пропорциональна концентрации
своб. лек. в-ва в плазме крови; канальцевая секреция реализуется насыщаемыми
транспортными системами в нефроне и характерна для нек-рых орг. анионов, катионов
и амфотерных соед.; реабсорбции могут подвергаться нейтральные формы лек. в-в.
Полярные лек. в-ва с мол. м. более 300 выводятся преим. с желчью и далее с калом:
скорость выведения прямо пропорциональна потоку желчи и отношению концентраций
лек. в-ва в крови и желчи. Остальные пути выделения менее интенсивны,
но м. б. исследованы при изучении Ф. В частности, нередко анализируют содержание
лек. в-ва в слюне, поскольку концентрация в слюне для мн. препаратов пропорциональна
их концентрации в крови, исследуют также концентрацию лек. в-в в грудном молоке,
что важно для оценки безопасности грудного вскармливания.
Математические модели.
Для обработки и интерпретации фармакокинетич. эксперимента используют разл.
варианты мат. моделирования. В т. наз. компартментальной (частевой, камерной)
модели организм представлен как совокупность взаимосвязанных абстрактных частей
(камер), между к-рыми и внутри к-рых происходят процессы распределения, метаболизма
и выведения лек. в-ва. При условии, что скорости этих процессов пропорциональны
концентрации (или кол-ву) лек. в-ва в той части, где этот процесс происходит,
изменение концентрации определяется ур-нием:
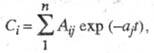
где n - число камер
модели, Aij - предэкспоненциальные множители, aj
- константа скорости, t - время.
Принципиальные недостатки
такой модели - неопределенность понятия "часть", невозможность строгой
идентификации числа частей и параметров, погрешности в статистич. оценках последних.
Для решения задач прикладной
Ф. широко используют методы системного подхода и теории вероятности. В первом
случае систему организм - лек. в-во рассматривают как целое ("черный ящик").
Для оценки параметров применяют принцип материального баланса, т. е. равенства
между кол-вами поступившего и выведенного лек. в-ва (после однократной дозы)
или достижения равенства скоростей поступления и выведения лек. ср-ва (при длит.
введении):
F·D=CL·AUC;
F·R = CL·Css
где D - доза, F-
степень всасывания, AUC - площадь под кинетич. кривой изменения концентрации
в крови (плазме, сыворотке) после однократного введения, R - скорость
поступления лек. в-ва в организм, Css - средняя
стационарная концентрация при длит, введении, CL - клиренс, кол-во крови
(в мл), к-рое очищается от лек. в-ва в единицу времени. При внутрисосудистом
введении F = 1. При внесосудистом введении степень всасывания (F)
оценивается путем сравнения площадей под кинетич. кривыми, соответствующими
разным путям введения лек. в-ва.
Вероятностный подход рассматривает
кинетич. кривые как кривые плотности распределения молекул лек. в-ва по времени
их пребывания в анализируемой среде. С помощью статистич. моментов рассчитывают
т. наз. немодельные параметры (среднее время удерживания лек. в-ва в организме,
клиренс лек. в-ва и объем его распределения).
Для решения задач фундам.
Ф. используют модель физиол. (перфузионного) типа (впервые предложили К. Бичофф
и P. Браун в 1966), где в качестве частей рассматриваются реальные органы и
ткани, связанные артериальным и венозным кровоснабжением. Параметры модели -
объемы органов, скорости кровотока через них, коэффициенты распределения лек.
в-ва между кровью и тканями, метаболич. и выделит. активность органов оцениваются
экспериментально. Реализация модели осуществляется путем решения системы дифференциальных
ур-ний с известными параметрами. Физиол. модель используется при решении такой
сложной и важной задачи, как межвидовой перенос данных Ф.
Влияние разл. факторов
на Ф. На фармакокинетич. процессы влияют: св-ва лек. формы и ее способность
высвобождать активное начало, физ. и хим. св-ва действующего в-ва (величина
молекулы, р-римость, липофильность, наличие полярных групп и активных центров
и др.), объем органов и тканей, скорость потока крови через них, проницаемость
капилляров и клеточных мембран, рН вне- и внутриклеточных сред, кол-во и активность
метаболич. ферментов и компонентов активных транспортных систем, характеристики
распределения между кровью и тканями, функцией, активность выделит, органов,
а также возраст, патологич., генетич. факторы, климат, характер питания, биол.
ритмы и т.д. К группам риска в Ф. относят больных пожилого и детского возраста,
беременных и больных с заболеваниями выделит, органов.
Ф. наряду с фармакодинамикой
(изучает действие лек. в-ва на организм) позволяет выработать основы рациональной
тактики лек. лечения.
Лит.: Соловьев В.H., Фирсов А.А., Филов В. А., Фармакокине-тика,М., 1980; Лакин К. M., Крылов Ю. Ф., Биотрансформация лекарственных веществ, M., 1981; Холодов Л.E., Яковлев В.П., Клиническая фармакокинетика. M., 1985; Wagner J. G., Fundamentals of clinical pharma-cokinetics, Hamilton, 1975. Л. E. Холодов, В. А. Горькое.


