ФАЗОВОЕ РАВНОВЕСИЕ,
сосуществование термодинамически равновесных фаз гетерогенной системы. Является
одним из основных случаев термодинамического равновесия и включает в
себя условия равенства т-ры всех частей системы (термич. равновесие), равенства
давления во всем объеме системы (мех. равновесие) и равенство хим. потенциалов
каждого компонента во всех фазах системы, что обеспечивает равновесное распределение
компонентов между фазами. Число фаз f, находящихся одновременно в равновесии,
связано с числом компонентов
k, числом n независимых параметров, определяющих состояние системы
(обычно, когда учитывается только влияние т-ры и давления, n = 2), и
числом термодинамич. степеней свободы v ур-нием: v = k + 2 - f
(см. Фаз правило).
В общем виде условие Ф.
р., согласно принципу равновесия Гиббса, сводится к максимуму энтропии S
системы при постоянстве внутр. энергии U, общего объема V и
числа молей каждого компонента ni-. Этот принцип можно
выразить также как условие минимума любого из термодинамич. потенциалов: внутр.
энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца
А при условии постоянства соответствующих параметров состояния, включая число
молей каждого компонента.
Ф.р. могут быть стабильными
и метастабильными. Те и другие являются локально устойчивыми, т. е. устойчивыми
по отношению к малым возмущениям параметров состояния -т-ры, давления, состава
(концентраций компонентов). Мета-стабильные Ф.р. отличаются тем, что они неустойчивы
к нек-рым конечным изменениям этих параметров, ведущим, в частности, к переходу
к другим фазам. Напр., пересыщенный р-р или переохлажденный расплав неустойчивы
по отношению к кристаллич. фазе. Поскольку метастабильное состояние системы
локально устойчиво, переход к стабильному состоянию требует преодоления нек-рого
активационного барьера и протекания процесса зародышеобразования (см. Зарождение
новой фазы).
Следует отметить нек-рые
особенности метастабильных фаз: при одной и той же т-ре давление пара выше над
метастабильной фазой, чем над стабильной; при одном и том же давлении т-ра плавления
метастабильной фазы ниже, чем стабильной; растворимость метастабильной фазы
при постоянных давлении и т-ре выше, чем стабильной. Последнее справедливо как
для жидких, так и для твердых р-ров.
Критерий достижения Ф.
р. Наиб. общий критерий достижения Ф.р.- сходимость значений CB-B системы при
их измерении, если подходить к состоянию Ф.р. сверху (со стороны более высоких
т-р) и снизу (со стороны низких т-р). Достижение Ф. р. или хотя бы приближение
к нему - важнейший вопрос при изучении диаграмм состояния, В т. ч. диаграмм
растворимости, диаграмм плавкости, диаграмм давления пара, а также в физико-химическом
анализе. При исследовании р-римости для достижения Ф. р. применяют длительную
(от неск. часов до неск. месяцев) выдержку образца с перемешиванием в термостате.
В случае образования в системе твердых р-ров рекомендуется подход к равновесию
сверху, от более высоких т-р, сочетающий быстрое охлаждение с целью получения
мелких кристаллов и интенсивное перемешивание. При исследовании систем методом
термического анализа обычно используют образцы, полученные сплавлением
компонентов с последующим медленным охлаждением. В случае образования в системе
твердых р-ров и инконгруэнтно плавящихся фаз, а также фаз, разлагающихся в твердом
состоянии, требуется проведение предварит. отжига образца при фиксированной
т-ре - от неск. часов до неск. месяцев. Для ускорения отжига сплавленных образцов
рекомендуется предварит. быстрое охлаждение расплава.
При изучении твердых тел,
состоящих из тугоплавких или разлагающихся при высоких т-рах компонентов, применяют
такие методы подготовки образцов, как прессование таблеток смесей перед отжигом
и промежут. перетирание смесей при отжиге, отжиг смесей солей или гелей, осажденных
из водных или других р-ров и т. п.
Типы Ф.р. В однокомпонентной
системе (при наличии полиморфных превращений) возможны 4 вида двухфазных равновесий:
жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4
вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл -
жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом
не учитывается возможность образования жидких кристаллов. В двойных системах
(компоненты А и В) возможны те же виды двухфазных равновесий, но число возможных
видов трехфазных равновесий достигает 26 вследствие того,
что играет роль не только природа сосуществующих фаз (их агрегатное состояние),
но и взаимное расположение фазовых полей на диаграмме состояния в координатах
т-ра -состав (давление предполагается постоянным). Все эти Ф. р. делятся на
два типа: эвтектич. Ф.р., при к-рых из трех одновременно участвующих в равновесии
фаз при понижении т-ры одна испытывает превращение, а две другие при этом образуются,
и пеrитектич. Ф.р., когда две фазы взаимодействуют (превращаются), при
этом образуется третья фаза. В простейшем случае, если на основе компонентов
А и В возможно образование жидкого р-ра L и двух твердых р-ров a
и b, звтектич. и перитектич. Ф. р. можно записать соотв. в виде р-ций:
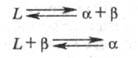
Поскольку в двойной системе
состояние трехфазного равновесия является нонвариантным, эвтектич. и перитектич.
р-ции происходят при постоянной т-ре, называемой соотв. эвтектической или перитектической,
т. е. на диаграмме состояния этим равновесиям отвечают горизонтали.
В случае, если в определенной
области т-р и составов все три равновесно сосуществующие фазы являются твердыми
(у одного из компонентов существуют полиморфные модификации с образованием твердого
р-ра g), возможны трехфазные равновесия, наз. эвтектоидными и перитектоид-ными.
Их можно представить соотв. р-циями, аналогично эвтектич. и перитектич. Ф.р.:
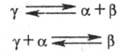
При наличии в нек-ром температурно-концентрационном
интервале двух жидких фаз L1 и L2 и одной твердой
(напр., а) возможны трехфазные равновесия, наз. монотектиче-ское и синтектическое:
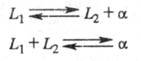
Нек-рые виды трехфазных
равновесий, напр. те, при к-рых образуется жидкость в результате взаимод. двух
кристаллич. фаз при понижении т-ры, теоретически возможны, но реально, по-видимому,
не наблюдаются. При переходе к тройным и более сложным системам число видов
многофазных Ф. р. возрастает еще больше (см. Тройная точка).
Распределение компонентов
между фазами системы при Ф.р. описывается законом распределения, устанавливающим,
что отношение термодинамич. активностей примеси в двух фазах при Ф. р. является
постоянной величиной. В первом приближении активности компонентов можно заменить
их концентрациями. Одним из условий выполнимости закона распределения в-ва между
фазами является одинаковость мол. состояния растворенного в-ва в обеих фазах,
т. е. отсутствие ассоциации молекул. Замена активностей на концентрации допустима,
если коэф. активности компонента в обеих фазах не зависят от концентрации, т.
е. для идеальных р-ров (это условие обычно выполняется для очень разб. р-ров,
в случае микроконцентраций). Отношение активностей компонентов наз. коэффициентом
распределения или коэф. относит. летучести и т. п.
Частные случаи закона распределения
- правила и законы, выражающие равновесное распределение в-ва в двухфазных системах.
Напр., для расчета равновесия жидкости и пара пользуются законами Рауля и Генри,
первым - для в-ва, находящегося в избытке, вторым - для в-ва, являющегося примесью
(см. Генри закон, Рауля закон). Распределение растворенного в-ва между
двумя несмешивающимися жидкостями при постоянной т-ре характеризуется тем, что
отношение его концентраций в этих двух фазах сохраняется постоянным (закон Бертло
- Нернста). Распределение примеси между жидкой и твердой кристаллич. фазой описывается
распределениями Хлопина (равновесия) и Дёрнера -Хоскинса (см. Соосаждение).
Законы распределения являются
основой разнообразных гетерогенных методов очистки (разделения), хотя само Ф.
р. в процессе проведения этих методов очистки достигается далеко не всегда,
а иногда сама возможность очистки обусловлена отсутствием Ф. р. (см. Кристаллизационные
методы разделения смесей, Ректификация, Экстракция жидкостная).
Лит.: Райнз Ф., Диаграммы фазового равновесия в металлургии, пер. с англ., M., 1960; Сторонкин А. В., Термодинамика гетерогенных систем, ч. 1-2, Л., 1967; Гиб б с Дж. В., Термодинамика. Статистическая механика, пер. с англ., 3 изд., M., 1982; Уэйлес С., Фазовые равновесия в химической технологии, пер. с англ., ч. 1-2, M., 1989. П. И. Федоров.


