ТРАНСГИДРОГЕНАЗА
(НАДФН:НАД оксидоредуктаза, НАДФ-трансгидрогеназа), фермент класса оксидоредуктаз,
катализирующий обратимый перенос гидрид-иона между двумя формами никотинамидных
коферментов (см. Ниацин, Коферменты)
НАДН + НАДФ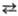 НАД
+ НАДФН
НАД
+ НАДФН
НАДН, НАД, а также НАДФН
и НАДФ-соотв. восстановленные и Окисленные формы коферментов никотинамид-адениндинуклеотида
и никотинамидадениндинуклеотид-фосфата.
У нек-рых бактерий родов
Pseudomonas и Azotobacter найдена цитоплазматич. Т., катализирующая установление
равновесия между НАДН и НАДФН, имеющими одинаковые стандартные окислит.-восстановит.
потенциалы (константа равновесия р-ции равна 1). Активность цитоплазматич. Т.
бактерий регулируется Са2+ и нуклеотидами.
У др. бактерий и высших
организмов Т. связана с мембраной и ее активность сопряжена с переносом Н+
через мембрану. Константа равновесия р-ции в этом случае зависит от разности
электрохим. потенциалов Н+ по разные стороны мембраны и достигает
величины 500.
Наиб. изучена Т. из митохондрий
сердца крупного рогатого скота. Фермент состоит из одной субъединицы с мол.
м. 120 тыс. В р-ре ПАВ и в мембране образует функционально активный димер. Первичная
структура субъединицы частично установлена. Высокоспецифичные ингибиторы не
найдены. Механизм р-ции, по-видимому, состоит в прямом переносе гидрид-иона,
т.к. фермент не содержит окислит.-восстановит. коферментов.
Физиол. роль Т. у высших
организмов состоит в йод-держании достаточного отрицат. окислит.-восстановит.
потенциала пары НАДФ/НАДФН благодаря энергии, продуцируемой в сопрягающих мембранах,
и регуляции тем самым р-ций с участием этих коферментов.
Лит.: Скулачев В.
П., Энергетика биологических мембран, М., 1989; Rydstrom J., "Biochim.
Biophys. Acta", 1977, v. 463, № 2, p. 155-84; Hoek J. В., Rydstrom
J., "Biochem. J.", 1988, v. 254, № 1, p. 1-10. А.Д. Виноградов.


