ТОК ОБМЕНА (плотность
тока обмена), осн. параметр электрохимической кинетики, характеризующий
равные по величине скорости катодного и анодного процессов при равновесном электродном
потенциале Ер; обозначается i0. Согласно
теории замедленного разряда, для окислит.-вос-становит. р-пии типа Ох + ne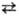 Red
при потенциале E скорости катодного (прямого)
Red
при потенциале E скорости катодного (прямого)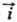 и
анодного (обратного)
и
анодного (обратного)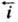 про
цессов равны соотв.:
про
цессов равны соотв.:
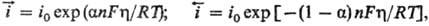
где h = Ep
— Е- сдвиг потенциала электрода по отношению к его равновесному значению
(см. Поляризация), a-эмпирич. постоянная, наз. коэффициентом
переноса (0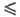 a
a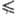 1),
Т- абс. т-ра, F - постоянная Фарадея, R - газовая постоянная.
При E = Ep h = 0 и
1),
Т- абс. т-ра, F - постоянная Фарадея, R - газовая постоянная.
При E = Ep h = 0 и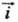 =
=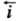 =
i0. Проходящий через электрохим. цепь измеряемый (внешний)
катодный ток i =
=
i0. Проходящий через электрохим. цепь измеряемый (внешний)
катодный ток i =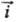 -
-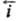 .
При условии h
.
При условии h RT/F!25
мВ
RT/F!25
мВ 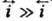 и i!
и i!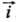 ,
откуда следует, что
,
откуда следует, что
h = -(RT/anF)lni0
+ RT/anFlni
(см. Тафеля уравнение).
С другой стороны, при |h|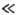 RT/F
h = iRT/nFi0. Т. обр., внеш. ток i
вызывает тем большие отклонения от равновесного значения электродного потенциала,
чем меньше i0. С ростом концентрации в-в Ох и Red и их адсорбируемости
на пов-сти электрода Т. о. увеличивается.
RT/F
h = iRT/nFi0. Т. обр., внеш. ток i
вызывает тем большие отклонения от равновесного значения электродного потенциала,
чем меньше i0. С ростом концентрации в-в Ох и Red и их адсорбируемости
на пов-сти электрода Т. о. увеличивается.
Приведенные выше ф-лы позволяют
рассчитать Т.о. на основе эксперим. зависимости h от i. Для одной
и той же р-ции катодного выделения Н2 в зависимости от природы электрода
и состава р-ра Т. о. может изменяться от 10 до 10 А/см2. Независимый
метод определения Т. о. основан на использовании радиоактивных изотопов. Напр.,
при E = Ер приводят в контакт амальгаму цинка,
содержащую радиоактивный изотоп Zn, С р-ром соли цинка со стабильным изотопом
и измеряют рост радиоактивности р-ра во времени. Скорость перехода радиоактивного
изотопа в р-р определяется величиной Т. о., поэтому его можно рассчитать по
изменению радиохим. активности р-ра.
Лит.: Дамаскин Б.
Б., Петрий О.А., Введение в электрохимическую кинетику, 2 изд., М., 1983, с.
234. Б. Б. Дамаскин.


