ТИОПИРИЛИЯ СОЛИ,
содержат в молекуле катион тиопирилия структуры I.
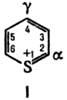
Т.е.-твердые, часто окрашенные
в-ва; окраска определяется природой заместителя в цикле и природой аниона. Т-ры
плавления хлоридов тиопирилия и 2,6-дифенилтиопирилия соотв. 142 и 133-136°С,
т-ры плавления перхлоратов 2-ме-тилтиопирилия и 2,6-дифенилтиопирилия соотв.
145-146 и 212-214 °С. Т.е. хорошо раств. в ацетоне, СНСl3, СН3СООН,
не раств. в диэтиловом эфире, воде.
Т.е. обладают св-вами ароматич.
соединений. Легко взаи-мод. с нуклеофилами. Так, напр., гидроксид-ион обычно
атакует в a- и g-положения с образованием неустойчивых псевдооснований,
для к-рых характерна кольчато-цепная таутомерия:
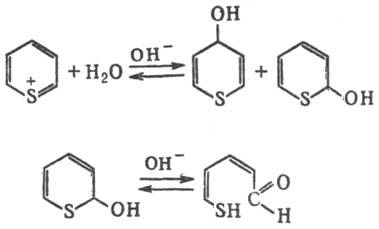
Р-пия Т.е. с алифатич.
аминами протекает по a-положению с размыканием цикла и возможной послед.
рециклиза-цией; с ароматич. аминами р-ция идет по одному из атомов гетероцикла:
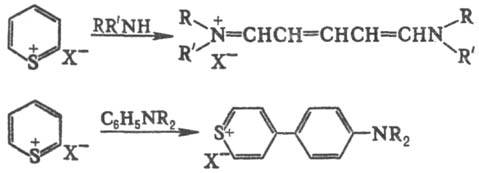
Третичные амины (трифениламин
и др.) образуют с Т.е. комплексы с переносом заряда.
При восстановлении LiAlH4
или NaBH4, а также при взаимод. с RMgHal Т.е. образуют тиопираны;
при катали-тич. гидрировании над Pd/C превращ. в тиациклогексаны,
при окислении МnО2-в тиопироны или производные тио-фена:
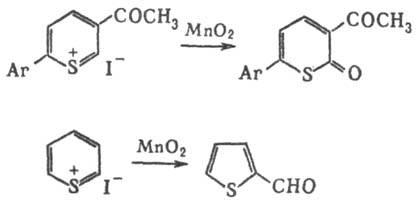
Получают Т.е. гл. обр.
из 1,5-дикарбонилъных соед., пиранов, солей пириллия или пиронов по р-циям:
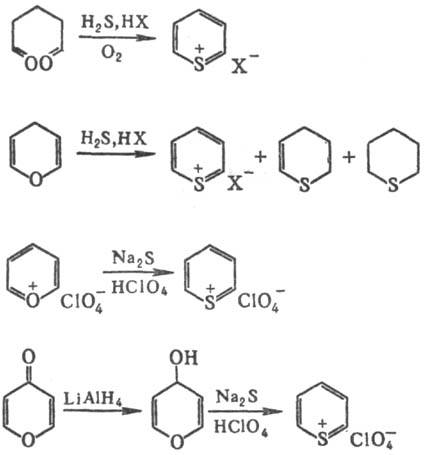
Т.с.-промежут. продукты
в орг. синтезе, фотосенсибилизаторы, красители для полимеров.
Лит.: Харченко В.
Г., Чалая С. Н., Коновалова Т.М., "Химия гете-ропикл. соединений",
1975, №2, с. 147-61; Харченко В. Г., Чалая С. Н., Тиопираны, соли тиопирилия
и родственные соединения, Саратов, 1987.
В. Г. Харченко, С. Н.
Чалая.


