ТИОКАРБОНОВЫЕ КИСЛОТЫ,
аналоги карбоновых к-т, в к-рых один атом кислорода замещен на атом серы. Существуют
в виде смеси таутомерных тиоловых RC(O)SH и тионовых RC(S)OH к-т с преобладанием
первых. В твердом состоянии и в концентрир. р-рах благодаря образованию водородных
связей Т.к. образуют димеры.
Низшие Т.к.-желтоватые
жидкости с неприятным запахом. У тиомуравьиной к-ты при т-ре выше 30 °С
появляется тенденция
к полимеризации, другие Т.к. термически очень стабильны.
Т.к.-более "сильные
к-ты, чем соответствующие карбо-новые к-ты; При диссоциации образуют тиокарбоксилат-анион.
Легко гидролизуются (особенно в присут. кислых или основных катализаторов) с
образованием карбоновых к-т и H2S.
Т.к.-эффективные ацилирующие
агенты, превращают спирты в сложные эфиры, меркаптаны-в эфиры тиолкар-боновых
к-т (S-эфиры), амины-в амиды. В среде сверхкислот при — 70°С Т.к. протонируются
по атому кислорода с образованием соответствующих карбениевых ионов; при повышении
т-ры до — 10-0°С образуются ацилиевые ионы:
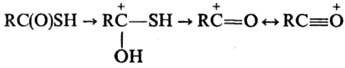
Алкилирование Т.к. алкилгалогенидами
в присут. оснований или спиртами (по Мицунобу реакции) приводит
к образованию S-эфиров, взаимодействие Т.к. с триалкилхлорсиланами или гексаметилдисилазаном-к
образованию О-три-алкилсилиловых эфиров, напр.:
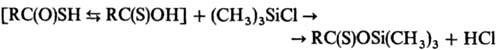
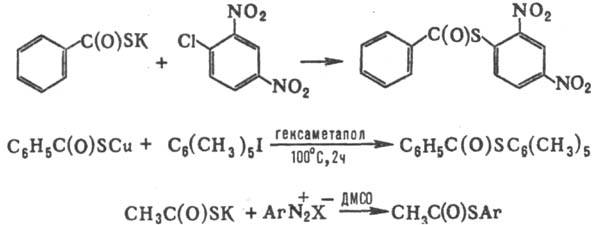
При арилировании Т.к. активир.
арилгалогенидами, в условиях р-ции Ульмана или солями диазония образуются S-ариловые
эфиры, напр.:
Т.к. присоединяются к неактивир.
алкенам и алкинам по радикальному механизму против правила Марковникова с образованием
соотв. S-алкиловых и S-алкениловых эфиров. Гидролиз S-эфиров Т.к., полученных
указанными выше способами,-удобный способ получения алкил- и арилмер-каптанов.
Эфиры тионкарбоновых к-т
(О-эфиры) получают либо из производных карбоновых к-т (напр., взаимод. эфиров
с P4S10 или реагентом Лавессона-продуктом р-ции анизола
с P2S5, имидоэфиров с H2S), либо присоединением
спиртов к тиокетенам.
Р-ция Т.к. с альдегидами
приводит к дитиоацилалям (р-ция 1), с нитрилами-к тиоамидам (2), с тиоцианатами-к
S-эфирам (3), с изотиоцианатами-к амидам (4), напр.:
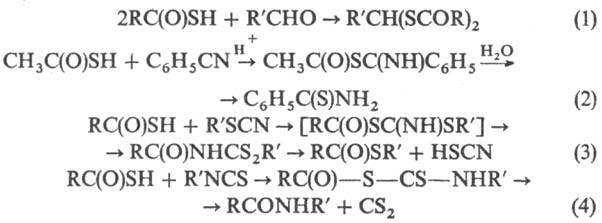
При взаимодействии Т.к.
с хлорангидридами карбоновых к-т образуются симметричные и несимметричные диацил-сульфиды,
при окислении мягкими окислителями (напр., иодом) - диацилдисульфиды.
Получают Т.к. взаимод.
магнийорг. соед. с COS (р-ция 5); действием оснований (NaH, диазабициклоундецен-ДБУ)
и COS на соед. с активной метиленовой или метальной группой; взаимод. Р4S10
с карбоновыми к-тами; р-цией H2S или NaSH с хлорангидридами, ангидридами
и эфирами карбоновых к-т; взаимод. CS2 с Na-солями амидов к-т (6,
7); присоединением H2S или Н2О к кетенам или тиокетенам
(8, 9):
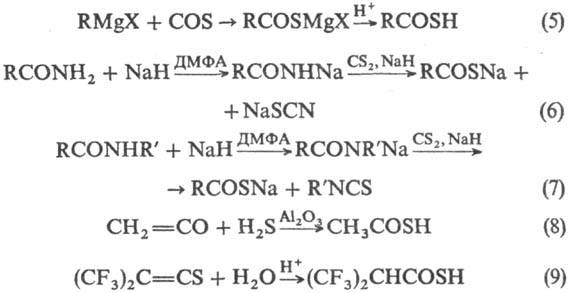
Т.к. могут быть выделены
из их производных, напр. действием H2S на S-эфиры в присут. третичных
аминов.
Т.к. применяют в качестве
ацилирующих агентов. Так, S-эфиры были использованы при полном синтезе макролид-ных
антибиотиков, кофермента А, в пептидном синтезе, Т. к.-заменители H2S
в аналит. химии.
См. также Дитиокарбоновые
кислоты, Тиоуксусная кислота.
Лит.: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 621-36; Houben-Wcyl, Methoden der organischen
Chemie, Bd E 5, Tl 1, Stuttg.-N. Y., 1985, S. 832-90, 785-812. B.H.
Дрозд.


