ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ,
состояние термодинамич. системы, не изменяющееся во времени и не сопровождающееся
переносом через систему в-ва или энергии. Если состояние системы не изменяется
во времени, но есть поток в-ва или энергии через систему, состояние системы
наз. стационарным. Изолированная система, не обменивающаяся со средой
в-вом и энергией, со временем всегда приходит к Т. р. и не может самопроизвольно
из него выйти. Постепенный переход системы из неравновесного состояния, вызванного
внеш. воздействием, в состояние Т. р. наз. релаксацией.
Т. р. включает: термич.
равновесие -постоянство т-ры в объеме системы, отсутствие градиентов т-ры; мех.
равновесие, при к-ром невозможны никакие макроскопич. перемещения частей системы,
т. е. имеется равенство давления в объеме системы; допустимы, однако, движения
системы как целого-поступат. движение в поле действия внеш. сил и вращение.
В случае гетерог. системы сосуществование термодинамически равновесных фаз наз.
фазовым равновесием. Если между компонентами системы происходят хим.
р-ции, в состоянии Т. р. скорости прямых и обратных процессов равны между собой
(см. Химическое равновесие). При Т. р. в системе прекращаются
все необратимые переноса процессы (теплопроводность, диффузия, вязкое
течение и т.п.). В системе не наблюдается изменение концентраций реагирующих
в-в, для закрытой системы характерно равновесное распределение компонентов
между составляющими систему фазами. Параметры состояния, определяющие Т. р.,
строго говоря, не являются постоянными, а флуктуируют около нек-рых статистич.
средних значений; обычно эти флуктуации пренебрежимо малы.
Принцип равновесия Гиббса.
Для k-компонентной r-фазной системы при постоянстве ее внутренней
энергии U, объема V и чисел молей компонентов ni (i
= 1, 2, ..., k) условие Т. р. заключается в том, что при всех
возможных изменениях параметров состояния энтропия 5 системы остается неизменной
или уменьшается. Иными словами, энтропия изо-лир. системы при Т. р. имеет условный
максимум:
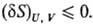
Буква d означает бесконечно
малую вариацию величины, в т.ч. флуктуацию, в отличие от знака дифференциала,
означающего действительно малое изменение величины в реальном процессе. Знак
равенства имеет место при протекании в системе обратимых процессов, знак неравенства-необратимых
(в случае изолир. системы). Принцип равновесия можно выразить также через термодинамические
потен-циалы-внутр. энергию U, энтальпию H, энергию Гиббса
G, энергию Гельмгольца F-при условиях, характеризуемых постоянством
соответствующих параметров состояния. Т. р. отвечает условный минимум термодинамич.
потенциалов:
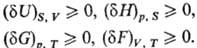
Переход системы из одного
состояния Т. р. в другое может происходить через последовательность состояний,
каждое из к-рых является также состоянием Т. р. Это означает, что параметры
состояния в течение всего процесса перехода бесконечно мало отличаются от своих
значений при Т.р. Это-равновесный (квазистатический) процесс. Реальные процессы
перехода всегда неравновесны; они изучаются химической термодинамикой.
Наряду с основным (глобальным)
максимумом энтропии и минимумами термодинамич. потенциалов, отвечающими стабильному
Т.р., в пространстве параметров состояния возможны локальные максимумы энтропии
и минимумы термодинамич. потенциалов. Соответствующие им состояния системы наз.
метастабильными равновесиями. Такие состояния, как и состояние стабильного Т.
р., локально устойчивы, т.е. устойчивы к бесконечно малым изменениям параметров
состояния. Но метастабильные состояния Т.р. могут быть неустойчивыми при нек-рых
конечных изменениях параметров.
Под локальным Т.р. в термодинамике
неравновесных процессов подразумевается равновесие в очень малых (элементарных)
объемах среды, содержащих все же достаточное число частиц (атомов, молекул,
ионов), чтобы состояние этих объемов можно было характеризовать т-рой, давлением,
хим. потенциалом и др. термодинамич. потенциалами, но не постоянными, а зависящими
от координат и времени. При локальном Т. р. элементарных объемов состояние системы
в целом неравновесное.
Лит. см. при ст.
Химическая термодинамика. П. И. Федоров.


