СУРЬМА (от тур. surme;
лат. stibium) Sb, хим. элемент V гр. периодич. системы, ат. н. 51, ат. м. 121,75.
Природная С.-смесь двух изотопов: 121Sb (57,25%) и 123Sb
(42,75%). Поперечное сечение захвата тепловых нейтронов 5,7 x x
10-28 м2. Конфигурация внеш. электронной оболочки атома
5s25p3; степени окисления +3 и +5, редко
— 3; энергии ионизации при последоват. переходе от Sb0 к Sb5+
8,64, 16,5, 25,3, 44,1, 60 эВ; сродство к электрону 0,94 эВ; электроотрицательность
по Полингу 1,9; атомный радиус 0,161 нм, ионные радиусы, нм (в скобках указаны
коорди-нац. числа): Sb3+ 0,090 (4), 0,94 (5), 0,090 (6), Sb5+
0,074 (6).
Содержание С. в земной
коре 5·10-5% по массе, в морской воде менее 5·10-4мг/л.
Известно ок. 120 сурьмяных минералов, из них важнейшие-антимонит Sb2S3,
самородная С., тетраэдрит Cu12Sb4S13, джемсонит
Pb4FeSb6S14, бертьерит FeSb2S4,
валентинит и сенармонтит Sb2O3, сер-вантит Sb2O4,
кермезит Sb2S2O. Наряду с собств. рудами (антимонитовыми
или с самородной С.) используют сурь-мяно-ртутные, медно-сурьмяные (тетраэдритовые),
золото-сурьмяные, сурьмяно-вольфрамовые руды. Попутно С. извлекают из свинцовых
концентратов, полученных из по-лиметаллич. руд.
Свойства. С.-серебристо-белый
металл с синеватым оттенком, грубозернистого строения. При обычном давлении
существует SbI, кристаллич. решетка тригональная (ром-боэдрич.) слоистая, а
— 0,45064 нм, a = 57,1°, z = 2, пространств. группа R3m.
При давлении ~5,5 ГПа SbI превращ. в кубич. модификацию SbII, при 8,5 ГПа-в
гексагональную SbIII, при давлениях выше 28 ГПа-в SbIV.
Известны три аморфные модификации
С. Желтая С. образуется при действии О2 на жидкий SbH3;
содержит химически связанный Н. При нагр., а также при освещении видимым светом
переходит в черную С. с плотн. 5,3 г/см3, к-рая м. б. получена при
конденсации паров С.; черная С. обладает полупроводниковыми св-вами. Взрывчатая
С-серебристо-белая, с металлич. блеском; плотн. 5,64-5,97 г/см3;
образуется при электролизе SbCl3 при малой плотности тока; содержит
связанный С1; взрывается при ударе и трении. Черная С. при нагр. до ~400°С
без доступа воздуха, а взрывчатая С. при растирании или ударе со взрывом превращ.
в металлическую С.
Для металлической С.: т.
пл. 630,5 °С, т. кип. 1634 °С; плотн. 6,69 г/см3, для жидкой
С. (при т-ре плавления) 6,65 г/см3; 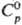 25,2 Дж/(моль·К);
25,2 Дж/(моль·К); 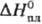 20,1 кДж/моль,
20,1 кДж/моль,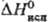 124,4 кДж/моль;
124,4 кДж/моль;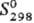 45,7
Дж/(моль · К); ур-ния температурной
зависимости давления пара: для кристаллической С. lgp(мм pт.cт.)=40,916-13570/T+8,592lgT
+ 1,521T (298-904 К), для жидкой С. lgр(мм рт.ст.) = 3,442-6007/T--
0,789lgT(904-1907 К), в парах в осн. присутствуют молекулы Sb, и Sb4;
температурный коэф. линейного расширения 9,2·10-6 K-1
(273 К); теплопроводность 18,8 Вт/(м·К) при 298 К; r 0,39 мкОм·м (273 К),
температурный коэф. r 4,73·10-3 K-1 (273-373
К); т-ра перехода в сверхпроводящее состояние 2,7 К; диамагнитна, магн. восприимчивость
—0,81·10-9. Твердость по Моосу 3, по Бринеллю 260 МПа; модуль упругости
55,98 ГПа; dраст 5 МПа, s ж 84 МПа. Хрупка,
но выше 310 °С становится пластичной. Монокристаллы высокой чистоты пластичны.
45,7
Дж/(моль · К); ур-ния температурной
зависимости давления пара: для кристаллической С. lgp(мм pт.cт.)=40,916-13570/T+8,592lgT
+ 1,521T (298-904 К), для жидкой С. lgр(мм рт.ст.) = 3,442-6007/T--
0,789lgT(904-1907 К), в парах в осн. присутствуют молекулы Sb, и Sb4;
температурный коэф. линейного расширения 9,2·10-6 K-1
(273 К); теплопроводность 18,8 Вт/(м·К) при 298 К; r 0,39 мкОм·м (273 К),
температурный коэф. r 4,73·10-3 K-1 (273-373
К); т-ра перехода в сверхпроводящее состояние 2,7 К; диамагнитна, магн. восприимчивость
—0,81·10-9. Твердость по Моосу 3, по Бринеллю 260 МПа; модуль упругости
55,98 ГПа; dраст 5 МПа, s ж 84 МПа. Хрупка,
но выше 310 °С становится пластичной. Монокристаллы высокой чистоты пластичны.
С. устойчива на воздухе,
выше ~600°С окисляется с образованием Sb2O3 (см. Сурьмы
оксиды). Не реагирует с N2, С, Si, В. Активно реагирует
с галогенами, кроме F2, измельченная горит в атмосфере Сl2
(см. Сурьмы галогениды). При сплавлении соединяется с S, Sе, Те
(см. Сурьмы халько-гениды), Р. При сплавлении с большинством металлов
образует антимониды. Не реагирует с соляной и фтористоводородной к-тами,
разб. H2SO4. Раств. в конц. Н2SО4 с
образованием Sb2(SО4)3, конц. HNO3
окисляется до сурьмяной к-ты H[Sb(OH)6]. Легко раств. в царской водке,
в смеси азотной и винной к-т. Р-ры щелочей и NH3 на С. не действуют,
расплавл. щелочи ее растворяют с образованием антимонатов.
Соли С. легко гидролизуются.
Осаждение гидроксисолей начинается при рН 0,5-0,8 для Sb(III) и рН 0,1 для Sb(V),
полное осаждение достигается соотв. при рН 2,2 и 1. Соед., образующиеся при
гидролизе Sb(III), содержат катион анти-монил SbO+.
Оксидам, галогенидам, халькогенидам
С., а также анти-монидам посвящены отдельные статьи. Из прочих соединений С.
наиб. важны следующие. Гидрид (стибин) SbН3-бесцв. газ; т. пл. -92,4°С,
т. кип. — 18,3°С; получают действием НС1 на антимониды Mg или Zn или солянокислого
р-ра SbCl3 на NaBH4; медленно разлагается при комнатной
т-ре, быстро при 150 °С; легко окисляется, горит на воздухе; мало раств.
в воде; используют для получения С. высокой чистоты; высокотоксичен.
Сульфат Sb2(SО4)3-бесцв.
кристаллы с шелковистым блеском; плотн. 3,62 г/см3; очень гигроскопичен,
расплывается на воздухе, водой гидролизуется до сульфата анти-монила (SbO)2SO4
и др. основных сульфатов; при 500 °С полностью разлагается; компонент пиротехн.
составов. Ниобат SbМbО4-бесцв. кристаллы с ромбич. решеткой (а
= 0,5561 нм, b = 0,4939 нм, с=1,1810 нм, z = 4, пространств.
группа Pna21); плотн. 5,68 г/см3; получают
спеканием оксидов Sb и Nb или гидротермальным путем; сег-нетоэлектрик, т-ра
Кюри 410 °С.
Гидроксооксалат Sb(С2О4)ОН-бесцв.
кристаллы; выше 275 °С разлагается с получением мелкодисперсной Sb2О3;
не раств. в воде и орг. р-рителях; получают действием щавелевой к-ты на р-р
SbС13; протрава при крашении.
Лактат Sb(СН3СНОНСОО)3-бесцв.
кристаллы, не раств. в воде; получают. взаимод. Sb(ОН)3 с молочной
к-той; фиксатор в ситцепечатании, протрава при гравировании.
Антимонилтартрат калия
К(SbО)(С4Н4О6)-0,5Н2О ("рвотный
камень")-бесцв. кристаллы; плотн. 2,7 г/см3; хорошо раств.
в воде; получают кипячением Sb2О3 с р-ром гидротартрата
К; протрава при крашении.
При спекании Sb2О3
с оксидами или карбонатами металлов без доступа воздуха образуются антимонаты(III)
(или антимониты). Антимонаты щелочных металлов, в особенности К, раств. в воде,
их р-ры-сильные восстановители. Все остальные антимонаты в воде не растворяются.
При нагр. на воздухе окисляются до антимонатов(V). Известны метаантимонаты(III),
напр. КSbО2, ортоантимонаты(III), как Na3SbO3,
и полиантимонаты, напр. NaSb5O8, Na2Sb4O7.
Для РЗЭ характерно образование ортоантимонатов LnSbO3, а также Ln3Sb5O12.
Антимонаты Ni, Мn и др.-катализа-торы в орг. синтезе (р-ции окисления
и поликонденсации), антимонаты РЗЭ-люминофоры.
Гексагидроксоантимонаты(V)—соли
гексагидроксо-сурьмяной к-ты НSb(ОН)6. Из них соли щелочных металлов
мало раств. в воде, все остальные-не растворяются. Получены для щелочных, мн.
двухвалентных, редкоземельных металлов. При нагр. они обезвоживаются с образованием
метаантимонатов(V), напр. М1SbО3. Гексагидроксоанти-монат
калия КSb(ОН)6-кристаллич. или аморфное в-во; раств. в воде (2,7%
по массе при 20 °С), не раств. в этаноле и ацетоне; получают взаимод. Sb2S3
с КОН и СиО в присут. воды; применяют для получения антимонатов(V), как реагент
для обнаружейия ионов Na+. Гексагидроксоанти-монат натрия NaSb(OH)6
в воде почти не раств. (0,1% по массе при 20 °С); получают при выщелачивании
щелочных сплавов рафинирования свинца с послед. очисткой; используют как компонент
шихты для эмалей, окислитель в орг. синтезе.
При действии р-ра КSb(ОН)6
на р-ры солей Al, Cr, Zr, Th, Sn и др. металлов, а также при совместном гидролизе
SbСl5 с хлоридами Ti, Nb и др. образуются рентгеноаморфные полимерные
антимонаты переменного состава. Их используют как химически- и радиационно-стойкие
селективные катионообменники. К этим соед. близки гетерополикисло-ты-сурьмяно-фосфорная,
сурьмяно-кремниевая и др. Это тоже полимерные в-ва переменного состава, используемые
как ионообменники.
Безводные антимонаты(V)
получают обычно спеканием оксидов или карбонатов металлов с оксидами С. на воздухе.
Для одновалентных металлов характерно образование мета-МSbО3 и ортоантимонатов
М3SbО4, для двухвалентных-мета- и пироантимонатов М2Sb2О7,
для трехвалентных-ортоантимонатов, напр. InSbO4.
Пироантимонат свинца Рb2Sb2О7-оранжево-желтые
кристаллы; разлагается выше 600 °С; не раств. в воде, неорг. к-тах и р-рах
щелочей, раств. в царской водке; получают сплавлением Pb(NO3)2
с антимонилтартратом К и NaCl; используют как пигмент (неаполитанский желтый)
для керамики.
Известны антимонаты, в
к-рых одновременно присутствует как Sb(III), так и Sb(V). Их примером Служит
серия соед. Na2Sb2O5, NaSb3O7
и NaSb5O9 со структурой типа пиро-хлора. См. также Сурьмаорганические
соединения.
Получение. Сурьмяные руды
обогащают с использованием гравитационных и флотационных методов. Для получения
С. чаще используют пирометаллургич. процессы - осадить плавку с железом или
(для частично окисленных руд или руд, содержащих драгоценные металлы) окислить
обжиг с возгонкой Sb2О3, к-рый далее подвергают восстановить
плавке. В обоих случаях в качестве флюсов применяют Na2CO3,
Na2SO4 или NaCl. Известны также реакц. плавка, основанная
на р-ции Sb2S3 + 2Sb2O3 :
6Sb + 3SO2, содовая плавка 2Sb2S3 + 6Na2CO3
+ 3С : 4Sb + 6Na2S + 6CO2, a также щелочная плавка.
Гидрометаллургич. способ—выщелачивание р-ром Na2S с NaOH с послед.
электролизом. Этот процесс применяют, в частности, к медно-сурьмяным тетра-эдритовым
концентратам.
Рафинирование С. огневым
способом включает удаление Fe и Сu действием Sb2S3 или
S, щелочное рафинирование-от As и S, очистку от Na действием SiO2
и разлив под слой расплава буры или NaSbO2 ("звездчатый шлак").
Для удаления Аu, Ag и Рb проводится электролитич. рафинирование с использованием
сульфатно-фторидных калиево-щелочных р-ров. С. высокой чистоты получают через
про-межут. соед.-SbСl3 или SbН3, очищаемые, напр., ректификацией.
Применяют также электролитич. рафинирование с использованием глицериново-щелочного
или ксилитово-щелочного электролита. Окончат. очистку С. осуществляют кристаллизац.
методами, в частности зонной плавкой.
Определение. Для
качеств. определения С. используют эмиссионный спектральный анализ (характеристич.
линии: 252,852; 259,806; 287,792; 323,252 нм), а также р-ции с Na2S2O3
(образуется красно-оранжевый осадок Sb2OS2), с родамином
С или с метиловым фиолетовым (фиолетовое окрашивание).
Для количественного определения
преимущественно используют титриметрические методы-броматометричес-кий, перманганатометрический
и др., основанные на окислении Sb(III) до Sb(V), а также фотометрические с образованием
желтого комплекса [SbI4]- или с образованием соед. комплекса
[SbCl6]- с основными красителями (бриллиантовый зеленый, кристаллический
фиолетовый, родамин С, метиленовый голубой и др.) и их экстракцией из р-ров.
Из гравиметрических методов
применяют осаждение в виде Sb2S3 из солянокислого р-ра,
осаждение пирогаллолом и др. Используют также люминесцентный, поля-рографич.,
амперометрич., атомно-абсорбционный и др. методы.
Применение. С.-компонент
сплавов на основе Рb и Sn (для аккумуляторных пластин, типографских шрифтов,
подшипников и др.), на основе Си и Zn, Sn (для художеств. литья). Чистую С.
используют для получения антимонидов с полупроводниковыми св-вами. Из С. получают
оксид, сульфид и др. ее соединения.
Пыль и пары С. вызывают
носовые кровотечения, сурьмяную "литейную лихорадку", пневмосклероз,
поражают кожу, нарушают половую функцию. Для пыли ПДК в воздухе рабочей зоны
0,5 мг/м3, в атм. воздухе 0,01 мг/м3, в почве 4,5 мг/кг,
в воде 0,05 мг/л.
Мировое производство С.
(без СНГ) в концентратах 70000 т. Осн. страны-производители-Боливия, ЮАР, КНР,
Мексика.
С. известна с глубокой
древности, в странах Востока ее применяли примерно за 3000 лет до н.э. Описание
св-в и способов получения С., а также ее соед. впервые дано Василием Валентином
в 1604.
Лит.: Сурьма, под
ред. С.М. Мельникова, М., 1977; Немодрук А. А., Аналитическая химия сурьмы,
М., 1978; Большаков К. А., Федоров П. И., Химия и технология малых металлов,
М., 1984; Ищанходжаев С., Химия сурьмы и свинца, Таш., 1984; Полывянный И. Р.,
Лата В. А., Металлургия сурьмы, А.-А., 1991. П. И. Федоров.


