СУЛЬФОНЫ, соед.
общей ф-лы RR'SO2 (R и R'- алкил, алкенил, алкинил, арил). Известны
также ди- и трисульфоны.
Назв. ациклических С. производят
от назв. орг. радикалов, связанных с группой SO2, с прибавлением
слова "суль-фон", напр. СН3(С6Н5)SО2-метилфенилсульфон;
назв. циклических С. производят от назв. углеводорода, в к-ром один из атомов
С замещен на атом S, напр. тиациклопентан-1,1-диоксид (сульфолан).
С. ограниченно распространены
в природе; в крови и надпочечникад нек-рых животных обнаружен диметил-сульфон.
С.-бесцв., б.ч. кристаллич.
в-ва, нек-рые низшие алифатические С.-высококипящие жидкости (см. табл.), без
запаха, хорошо раств. во мн. орг. р-рителях, нек-рые низкомолекулярные С. раств.
в воде. По сравнению с сульфокси-дами С. характеризуются низкой основностью
и сравнительно высокой СН-кислотностью.

В ИК спектрах С. присутствуют
характеристич. полосы в области 1300-1320 и 1140-1160 см-1, соответствующие
асимметрическим и симметрическим колебаниям группы SO2·
Для С. характерна высокая
хим. и термич. стабильность. К большинству восстановителей С. инертны, при действии
(изо-С4Н9)2А1Н (в эфире или ТГФ) либо
LiAlH4 на циклические С. образуются сульфиды.
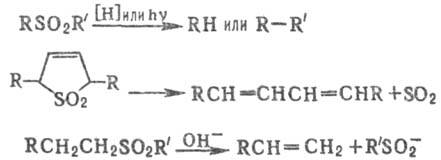
С. элиминируют молекулу
SO2 при УФ облучении или нагр., а также при действии нек-рых восстановителей;
в щелочных условиях С. подвергаются 1,2-элиминированию с образованием сульфинат-ионов,
напр.:
С. вступают в р-ции с диазометаном,
карбонильными, галогенсодержащими и др. соед., напр.:
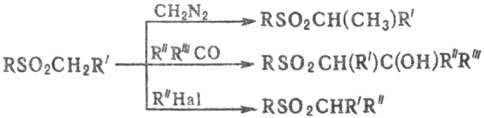
При действии сильных оснований
на a-галогенсульфоны образуются алкены со строго определенным положением
двойной связи (Рамберга - Бэклунда реакция).
С. легко генерируют a-сульфонилкарбанионы,
к-рые являются синтетич. интермедиатами в р-циях галогенирова-ния, алкилирования
и др.:
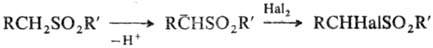
Ароматические С. подвергаются
внутримол. перегруппировке под действием литийорг. соединений с образованием
бензилсульфиновых к-т (см. Смайлса перегруппировка).
Получают С. окислением
сульфидов или сульфоксидов (окислители-Н2О2 в СН3СООН,
м-хлорнадбензойная к-та, KMnO4, Na2Cr2O7
и др., р-ция 1); алкилированием сульфи-новых к-т или сульфинатов (2); термич.
перегруппировкой аллилсульфинатов, при этом может образовываться два разл. продукта
(3), напр.:
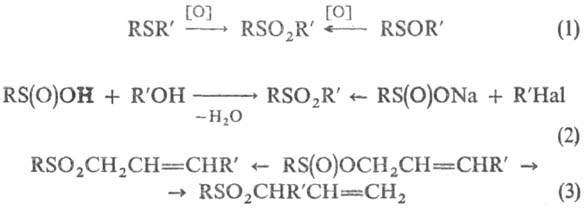
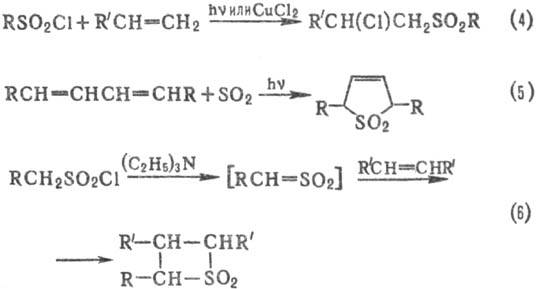
С. получают также свободнорадикальным
присоединением сульфонилгалогенидов к ненасыщ. соединениям (4); цик-лоприсоединением
SO2 к диенам (5); взаимод. сульфенов, генерируемых из алкансульфонилхлоридов,
с алкенами (6), напр.:
Диарил- и алкиларилсульфоны
получают взаимод. сульфонилгалогенидов с ароматич. соединениями в условиях р-ции
Фриделя - Крафтса:
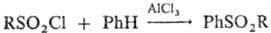
В дисульфонах группы SO2
могут находиться в a-, b- или g-положениях. a-Дисульфоны
RSO2SO2R' при кипячении в водных r-pax, особенно
в присут. щелочей или аминов, распадаются на сульфоновые и сульфиновые к-ты.
b-Дисуль-фоны RS02C(R')(R:)SO2R (R-Alk, Аг,
R' и R:-H, Alk, Ar) при R' = R: = H обладают кислыми св-вами,
раств. в щелочах, легко замещают атом H на др. группы. g-Дисуль-фоны
RSO2CH2CH(R')SO2R (R и R'-Alk, Ar) под действием
оснований или при нагревании отщепляют сульфино-вую кислоту и образуют b-гидроксисульфоны
или непредельные С.
Для получения дисульфонов
используют те же методы, что и для С.; a-дисульфоны м. б. получены также
осторожным окислением тиолсульфонатов Н2О2 либо сульфиновых
к-т КМnO4 в СН3СООН.
Трисульфоны (RSO2)3CR'
(R-Alk, Ar, R'-H, Alk, Ar) при R' = H-сильные к-ты, со щелочами образуют
соли, по атому H галогенируются, нитруются. При кипячении в щелочах гидролизуются.
Получают окислением (Н2О2, КМnО4) тритиоортоэфиров.
Наиб. практич. применение
находят ароматические С. Пластмассы на основе ариленсульфонов используют для
изготовления конструкц. и электротехн. материалов. Сульфолан и сульфолен-р-рители.
Нек-рые С. применяют в качестве лек. средств; напр., 4,4'-диаминодифенилсульфон
(диафенилсульфон) и его аналог солюсульфон используют для лечения лепры (проказы).
См. также Сульфолан, Сулъфолены.
С. в осн. малотоксичны;
исключение составляют дивинил-сульфон и его предшественник - b, b'-дихлордиэтилсульфон
(продукт окисления иприта).
Лит.: Сьютер Ч.,
Химия органических соединений серы, пер. с англ., т. 3, М., 1951; Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 318-70.
А. Ф. Елеев.


