СТРОНЦИЯ ОКСИД SrO,
бесцв. кристаллы с кубич. кристаллич. решеткой типа NaCl (a = 0,5083
нм, пространств. группа Fm3m); плотн. 4,7 г/см3; т.
пл. 2660 °С; 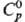 44,98 ДжДмоль · К);
44,98 ДжДмоль · К); 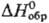 - 590,5 кДж/моль, DHпл 70 кДж/моль;
- 590,5 кДж/моль, DHпл 70 кДж/моль;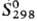 55,44
Дж/(моль·К). Соотношение атомов О и Sr в С. о. незначительно отклоняется от
стехиометри-ческого в сторону избытка Sr или О при прокаливании кристаллов соотв.
в парах Sr или в О2. Избыток Sr достигает 1·10-4 молей
(в моле SrO) при 1140-1320 °С, а избыток кислорода-от 5·10-3
до 1·10-3 молей О в интервале 700-1150 °С при давлении О2
105 Па.
55,44
Дж/(моль·К). Соотношение атомов О и Sr в С. о. незначительно отклоняется от
стехиометри-ческого в сторону избытка Sr или О при прокаливании кристаллов соотв.
в парах Sr или в О2. Избыток Sr достигает 1·10-4 молей
(в моле SrO) при 1140-1320 °С, а избыток кислорода-от 5·10-3
до 1·10-3 молей О в интервале 700-1150 °С при давлении О2
105 Па.
При прокаливании SrO в
среде О2 при высоком давлении образуется пероксид SrO2;
давление диссоциации SrO2:l,01 x x 105 Па
(365 °С), 5,07·106 Па (500 °С), 1,01 · 107 Па
(600 °C). При взаимод. с водой SrO образует гидроксид Sr(OH)2-.
бесцв. гигроскопичные кристаллы тетрагон. сингонии; т. пл. 535 °С; плотн.
3,63 г/см3; 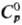 92,06 ДжДмоль · К);
92,06 ДжДмоль · К);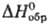 —965 кДж/моль;
—965 кДж/моль; 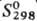 94 Дж/(моль · К). При избытке воды
образует кристаллогидраты Sr(ОН)2·nН2О, где n
= 1, 8. Октагидрат-бесцв. кристаллы тетрагон. сингонии (а = = 0,897 нм,
с = 0,1115нм); плотн. 1,90 г/см3; может находиться в равновесии
с насыщ. водным р-ром Sr(ОН)2, при нагр. в сухом воздухе превращ.
в моногидрат, затем-в безводный гидроксид при 100°С, к-рый при 400 °С
разлагается до SrO; р-римость октагидрата в воде (г в 100 г, в пересчете на
SrO): 0,35 (0°С), 0,69 (20 °С), 2,18 (50 °С), 24,2 (100°С).
При обработке кристаллич. Sr(OH)2 пероксидом Н2О2
образуется SrO2·8Н2О.
94 Дж/(моль · К). При избытке воды
образует кристаллогидраты Sr(ОН)2·nН2О, где n
= 1, 8. Октагидрат-бесцв. кристаллы тетрагон. сингонии (а = = 0,897 нм,
с = 0,1115нм); плотн. 1,90 г/см3; может находиться в равновесии
с насыщ. водным р-ром Sr(ОН)2, при нагр. в сухом воздухе превращ.
в моногидрат, затем-в безводный гидроксид при 100°С, к-рый при 400 °С
разлагается до SrO; р-римость октагидрата в воде (г в 100 г, в пересчете на
SrO): 0,35 (0°С), 0,69 (20 °С), 2,18 (50 °С), 24,2 (100°С).
При обработке кристаллич. Sr(OH)2 пероксидом Н2О2
образуется SrO2·8Н2О.
С. о.-компонент оксидных
катодов (эмиттеров электронов в электровакуумных приборах), стекла кинескопов
цветных телевизоров (поглощает рентгеновское излучение), эмалей и глазурей,
высокотемпературных сверхпроводников, пиротехн. составов; его применяют для
выделения сахара из патоки (гидроксид), как исходное в-во для получения Sr.
Лит.: Ковтуненко
П. В., Хариф Я. Л., "Успехи химии", 1979, т.48, в. 3, с. 448-80.
П.В. Ковтуненко, Я. Л. Хариф.


