СТРОНЦИЙ (от назв.
деревни Строншиан, Strontian, в Шотландии, близ к-рой был обнаружен; лат. Strontium)
Sr, хим. элемент II гр. периодич. системы, ат. н. 38, ат. м. 87,62; относится
к щелочноземельным элементам. Природный С. состоит из четырех стабильных
изотопов: 88Sr(82,56%), 86Sr(9,86%), 87Sr(7,02%)
и 84Sr(0,56%). Поперечное сечение захвата тепловых нейтронов для
прир. смеси изотопов 1,21·10-28 м2. Конфигурация внеш.
электронной оболочки атома 5s2; степень окисления +2,
очень редко + 1; энергии ионизации Sr0 : Sr+ :
Sr2+ соотв. равны 5,69410 и 11,0302 эВ; электроотрицательность по
Полингу 1,0; сродство к электрону —1,51 эВ; работа выхода электрона 2,35 эВ;
атомный радиус 0,215 нм, ионный радиус (в скобках указано координац. число)
Sr2+ 0,132 нм (6), 0,140 нм (8), 0,150 нм (10), 0,158 нм (12).
Содержание С. в земной
коре 3,4·10-2% по массе, в океа-нич. водах 11097000 т (8,1 мг/л).
В своб. виде не встречается. С. образует ок. 40 минералов, из к-рых пром. значение
имеют целестин (целестит) SrSO4 и стронцианит SrCO3. С.
присутствует в качестве изоморфной примеси в разл. магниевых, кальциевых и бариевых
минералах, а также содержится в прир. минерализов. водах (ок. 24% общих запасов
С.). Среднее содержание С. в почвах 0,035% по массе, в речной воде 0,08 мг/л.
Часть С. в океане концентрируется в железомарганцевых конкрециях (4900 т в год).
Осн. месторождения стронциевых руд в СНГ, Великобритании, ФРГ, Франции, Испании,
Мексике, США, Канаде и др.
Свойства. С.-мягкий серебристо-белый
металл, ковкий и пластичный. В неочищенном состоянии окрашен в желтый цвет.
Существует в трех полиморфных модификациях: до 231°С устойчив a-Sr
с кубич. гранецентрир. решеткой типа Сu, а = 0,6085 нм, z = 4,
пространств. группа Fm3m, плотн. 2,63 г/см5; при т-рах
231-623°C-b-Sr с гексагон. решеткой типа Mg, а = 0,431 нм, с
= 0,705 нм, z = 2, пространств. группа Р63/ттс;
выше 623 °C-g-Sr с кубич. объемноцентрир. решеткой типа a-Fe,
а = 0,485 нм, z = 2, пространств. группа Iт3т. Т.пл.
768 °С, т. кип. 1390°С; 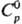 26,79
Дж/(моль·К); DHпл 8,2 кДж/моль, DHисп
133,8 кДж/моль,
26,79
Дж/(моль·К); DHпл 8,2 кДж/моль, DHисп
133,8 кДж/моль, 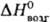 160,5 кДж/моль;
160,5 кДж/моль;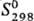 55,70 Дж/(моль·К); давление пара 2,254 x
10-6 Па (500 К), 2,861·10-4 Па (580 К), 1,12·10-2
Па (660 К), 245,9 Па (1043 К); температурный коэф. линейного расширения 20,6·10-6
К-1 (273-503 К), 22,6·10-6 К-1 (503-773 К);
r 0,2 мкОм·м (0°С), 21,5 мкОм·м (22 °С), 60 мкОм·м (400 °С),
температурный коэф. r 5,2·10-3 К-1 (273-473 К); парамагнетик,
магн. восприимчивость + 1,05·10-9; g 350 мН/м (768°С). Пластичен,
модуль упругости 16,0 ГПа, модуль сдвига 6,08 ГПа; sраст 49,0
МПа (20 °С), 53,9 МПа (110°С), 200 МПа (200 °С), 1,0 МПа (700 °С);
твердость по Бринеллю 190 МПа (20 °С), 90 МПа (200 °С), 2,0 МПа (700
°С); относит. удлинение 1,0% (20 °С), 5,3% (200 °С), 40% (700 °С).
55,70 Дж/(моль·К); давление пара 2,254 x
10-6 Па (500 К), 2,861·10-4 Па (580 К), 1,12·10-2
Па (660 К), 245,9 Па (1043 К); температурный коэф. линейного расширения 20,6·10-6
К-1 (273-503 К), 22,6·10-6 К-1 (503-773 К);
r 0,2 мкОм·м (0°С), 21,5 мкОм·м (22 °С), 60 мкОм·м (400 °С),
температурный коэф. r 5,2·10-3 К-1 (273-473 К); парамагнетик,
магн. восприимчивость + 1,05·10-9; g 350 мН/м (768°С). Пластичен,
модуль упругости 16,0 ГПа, модуль сдвига 6,08 ГПа; sраст 49,0
МПа (20 °С), 53,9 МПа (110°С), 200 МПа (200 °С), 1,0 МПа (700 °С);
твердость по Бринеллю 190 МПа (20 °С), 90 МПа (200 °С), 2,0 МПа (700
°С); относит. удлинение 1,0% (20 °С), 5,3% (200 °С), 40% (700 °С).
С. отличается большой хим.
активностью, по хим. св-вам сходен с Са и Ва. Стандартный электродный потенциал
Sr2+ /Sr0 — 2,89 В. При обычных т-рах металлич. Sr взаимод.
с воздухом, покрываясь пленкой из SrO и SrO2 (см. Стронция оксид),
при нагр. воспламеняется. Энергично реагирует с водой с образованием Sr(OH)2
и выделением Н2. Металлический С. взаимод. с галогенами, образуя
стронция гало-гениды. С СО2 реагирует при повыш. т-рах: 5Sr
+ 2 СО2 : : SrC2 + 4 SrO. При 300-400 °С
с Н2 образует гидрид SrH2, при
натр. с S, Se и Те-соотв. сульфид SrS, селенид SrSe и теллурид SrTe, с N2-нитрид
Sr3N2, с углеродом-карбид SrC2, с газообразным
NН3-амид Sr(NH2)2 и т.д.
В расплавл. состоянии С.
образует однородные расплавы (р-ры) со многими металлами, с Са и Ва дает непрерывный
ряд твердых р-ров, образует интерметаллиды, напр. SrAl, SrAl4, SrMg2.
С. раств. в разб. к-тах
с образованием солей и Н2. Конц. H2SO4 дает
с С. SrSO4, SO2, H2S и S, конц. HNO3-Sr(NO3)2
и NO. При растворении С. в жидком NH3 м.б. получен аддукт Sr(NH3)6.
Хорошо раств. в воде хлорид, бромид, иодид, ацетат и нек-рые др. соли С., плохо
раств. сульфат, фторид, карбонат, оксалат, арсенит, хромат, иодат, фосфат, молибдат
С.
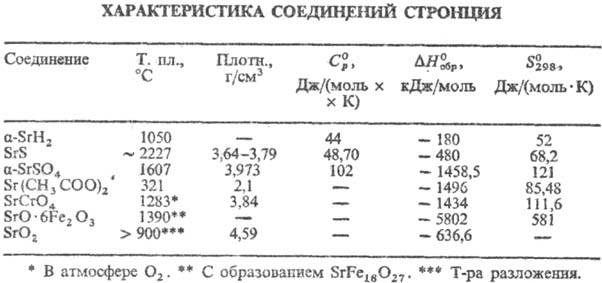
Сульфат SrSО4-бесцв.
кристаллы ромбич. сингонии (см. табл.); выше 1157°С переходит в гексагон.
b-SrSO4, DH перехода a:b 10 кДж/моль;
разлагается выше 1580°С; р-римость в воде 0,0113 г в 100 мл при 0°С;
получают осаждением из р-ров солей С. сульфатом Na; наполнитель при изготовлении
красок и резины, утяжелитель в буровых жидкостях. Хромат SrCrO4-желтые
кристаллы моноклинной сингонии; получают осаждением из р-ров Н2СrО4
и Sr(OH)2; желтый пигмент в произ-ве лаков, художеств, красок
("стронционовый желтый"), антикоррозионное покрытие для Zr, Mg,
Al. Гексаферрит SrO·6Fe2 O3 получают спеканием смеси Fe2O3
и SrCO3 при 1000 °С; магн. материал.
Гидрид SrН2-бесцв.
кристаллы ромбич. сингонии, выше 355 °С существует p-SrH2, DH
полиморфного перехода 7,2 кДж/моль; получают восстановлением SrO водородом при
700-800 °С или из Sr и Н2. Сульфид SrS-бесцв. кристаллы кубич.
сингонии; разлагается водой; получают при нагр. Sr и S, восстановлением SrSO4
углем, Н2 и др.; компонент люминофоров, фосфоресцирующих составов,
ср-во для удаления волос в кожев. пром-сти.
См. также Стронция карбонат,
Стронция нитрат, Стронция титанат.
Получение. Источники получения
С.-прир. минералы целестин и стронцианит, перспективно использование прир. минерализов.
вод. С. получают электролизом расплава SrCl2, а также металлвтермич.
восстановлением SrO или SrCl2. Электролиз расплава (85% SrCl2
+ KC1 или NH4C1) ведут на никелевом или железном катоде при 800 °С.
Предварительно восстанавливают целестиновый концентрат до SrS углем при нагр.
с послед. обработкой SrS соляной к-той и обезвоживанием образовавшегося SrCl2.
Полученный этим методом С. содержит 0,3-0,4% К. Для металлотермич. восстановления
SrO используют Al, Si или ферросилиций. Процесс ведут при 1000°С в вакууме
в стальной трубке. SrCl2 восстанавливают металлич. Mg в атмосфере
Н2.
Стронцианитовый концентрат
разлагают обжигом при 1200°С с послед. растворением SrO в воде или к-тах
либо непосредств. растворением стронцианита в азотной или соляной к-те.
С. может быть также получен
при нагр. в вакууме SrH2 (1000°С), Sr3N2
(140-150°C) или Sr(NH3)6. С. очищают перегонкой в
вакууме. Радиоактивные изотопы С. образуются при делении 235U. Изотоп
89Sr(T1/2 50,5 сут) получают
также в реакторах из стабильного С. по р-ции: 88Sr(n, g)
89Sr или в циклотроне: 88Sr(d, p) 89Sr.
Определение. Наиб. надежный
метод качеств. обнаружения и количеств. определения С. в прир. и пром. объектах-пламенная
фотометрия. Качественно С. может быть обнаружен по карминово-красному окрашиванию
пламени. Количественно С. определяют также гравиметрически в виде сульфата (осаждением
из водно-этанольного р-ра), карбоната или оксалата, а также методом комплексонометрич.
титрования комплексоном III.
Радиоактивный С. определяют
по дочернему 90Y, осаждаемому в виде оксалата. В продуктах питания
и золе костной ткани 90Y выделяют экстракцией. В пищ. продуктах,
растительности и костной ткани 89Sr определяют осаждением дымящей
HNО3 с послед. определением активности 89Sr.
Применение. Металлический
С. ограниченно используют в технике для раскисления меди и бронзы, в качестве
легирующих добавок к сплавам Mg, Al, Pb, Ni и Сu, как геттер в электровакуумной
технике. Более широко используют соединения С. при изготовлении спец. оптич.
стекол, стекол для кинескопов электронных трубок, в пиротехн. составах (дают
карминово-красное пламя), фосфоресцирующих составах, в произ-ве ферромагн. и
люминесцентных материалов, эмиссионных покрытий радиоламп и т.д.
Соли С., в т. ч. радиоактивного
С., применяют в терапии кожных болезней, соли жирных к-т-при изготовлении консистентных
смазок. 90Sr-источник b-излучения.
Хранят С. в закрытой стеклянной
посуде под слоем керосина.
Осн. источники загрязнения
природы стабильным С.-сточные воды металлургич., электротехн., стекольного,
ке-рамич. и свеклосахарного произ-ва. Радиоактивный С. может поступать в окружающую
среду в результате ядерных испытаний и аварий на АЭС. При крупных ядерных испытаниях
выход 90Sr(T1/2 29,12 лет, b-излучатель) составляет
3,5%. Небольшие кол-ва 90Sr, образующиеся в ядерных реакторах, из-за
дефектов в оболочке твэла могут поступать в теплоноситель, а затем при его очистке
попадать в жидкие и газообразные отходы. 90Sr как аналог Са активно
участвует в обмене в-в у растений. В растения 90Sr попадает при загрязнении
листьев и из почвы через корни. Особенно много 90Sr накапливают бобовые,
корне- и клубнеплоды и злаки.
При избытке С. прежде всего
поражаются костная ткань, печень и кровь. ПДК С. в воде 8 мг/л, в воздухе для
гидроксида, нитрата и оксида С. 1 мг/м3, для карбоната, сульфата
и фосфата 6 мг/м3. Радиоактивный С. избирательно накапливается в
скелете, мягкие ткани задерживают менее 1%, с возрастом отложение 90Sr
в скелете понижается, у мужчин он накапливается больше, чем у женщин, в первые
месяцы жизни ребенка отложение 90Sr на порядок, а 89Sr
на два порядка выше, чем у взрослого человека. Для категории А допустимая концентрация
90Sr в воздухе рабочей зоны ДКА 4,4·10-2 Бк/л,
допустимое содержание в костях ДСА 7,4·104 Бк, в легких
2,8·104 Бк.
С. открыт в 1790 А. Крофордом,
металлический С. получен впервые Г. Дэви в 1808.
Лит.: Получение
стронция. Обзор литературы, М., 1972; Аналитическая химия стронция, М.„ 1978;
Технология соединений бария и стронция, под ред. Ф.И. Стригунова, Э.Б. Гитиса,
Хр., 1979; Алейникова М. Л., Клименко И. А., Стронций в природных и сбросных
водах и способы его извлечения, М., 1980; Вредные химические вещества. Радиоактивные
вещества. Справочник, Л., 1990. В. П. Данилов.


