СТЕФЕНА РЕАКЦИЯ,
получение альдегидов из нитрилов действием на последние НС1 и SnCl2
с послед. гидролизом промежуточно образующейся соли альдимина:
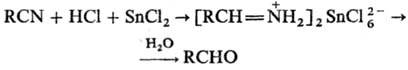
В р-цию вступают мн. алифатич.,
жирно-ароматич., арома-тич. и нек-рые гетероциклич. нитрилы. Р-цию обычно проводят
при комнатной т-ре, насыщая газообразным НСl суспензию безводного SnCl2
в сухом диэтиловом эфире.
Затем к суспензии при перемешивании
приливают р-р нитрила в диэтиловом эфире, выпавший осадок соли альдимина отделяют
и гидролизуют нагреванием с водой. Выход альдегидов в ряде случаев возрастает
(он может достигать 90%), если вместо диэтилового эфира используют этилацетат
или этилформиат, вместо SnCl2-SnBr2, а также при предварит.
насыщении р-ра нитрила в диэтиловом эфире газообразным HCl.
С. р. не универсальна.
Мн. нитрилы не удалось вовлечь в нее из-за стерич. препятствий или низкой реакц.
способности цианогруппы. Электронодонорные заместители увеличивают нуклеоф.
св-ва цианогруппы и облегчают р-цию, электроноакцепторные - замедляют ее.
Механизм С. р. включает
неск. стадий:
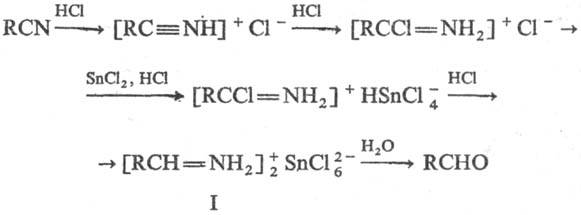
При действии на соль альдимина
(I) спиртов или третичных аминов м. б. получены соотв. ацетали RCH(OR)2
или альдимины RCH = NH. Алифатич. нитрилы нормального строения, содержащие семь
и более атомов углерода, вместо альдегидов образуют смесь диамида RCH(NHCOR)2
и амида RC(O)NH2.
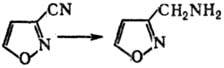
В условиях С. р. динитрилы
двухосновных карбоновых к-т алифатич. ряда образуют нитрилиевые соли, нек-рые
гетероциклич. нитрилы-первичные амины, напр.:
Часто в рамках С. р. рассматривают
и др. р-ции восстановления нитрилов, ведущие к образованию альдегидов, напр.
р-цию с LiAlH4 или с никелем Ренея в среде муравьиной к-ты, поскольку
все они протекают через промежут. альдимины.
С. р. используют в орг.
синтезе для получения альдегидов и их нек-рых производных. Р-ция открыта в 1925
Г. Сте-феном.
Лит.: Моветтиг Э.,
в сб.: Органические реакции, пер. с англ., сб. 8, М., 1956, с. 288-332; Зильберман
Е.Н., Реакции нитрилов, М., 1972. С. К. Смирнов.


