СТАНДАРТНЫЙ ПОТЕНЦИАЛ
(нормальный потенциал), значение электродного потенциала, измеренное
в стандартных условиях относительно выбранного электрода сравнения (стандартного
электрода). Обычно С. п. находят в условиях, когда термодинамич. активности
а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом
электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105
Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный
электрод (Pt; H2 [1,01·105Па], Н+ [a=1]),
потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения):
С. п. равен эдс электрохимической цепи, составленной из исследуемого
и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схе-матич.
изображении цепи (гальванич. ячейки) водородный электрод всегда записывается
слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным,
если в режиме "источник тока" слева направо во внеш. цепи движутся
электроны, а в р-ре - положительно заряженные частицы. Напр., С. п. хлорсеребряного
электрода равен эдс гальванич. ячейки
-Pt, Н2[1,01·105Па]|НС1(аb=l)|AgCl,
Ag|Pt +
Для любой электродной р-ции,
включающей перенос n электронов, электродный потенциал определяется ур-нием:
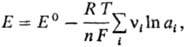
где Е°-С. п.
электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная
Фарадея, аi-термодинамич. активность частиц (как заряженных,
так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич.
коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных
в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят
в левую часть ур-ния, напр. AgCl + е : Ag + С1-). Значения
С. п. для ряда электродных процессов в водной среде приведены в таблице в порядке
убывания окислит. способности соответствующих систем. С. п. металлов и водорода,
расположенные в порядке их возрастания, составляют электрохимический ряд
напряжений.
С. п. определяется либо
непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией
на бесконечно разб. р-ры, либо расчетом - по данным о стандартных значениях
изменения энергии Гиббса хим. р-ции DG0. В последнем
случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна
из к-рых -окис-лит.-восстановит. р-ция с искомым С. п. 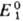 ,
а другая-с известным С. п. .
,
а другая-с известным С. п. .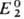 .
Если в условной схеме ячейки 1-й электрод записан слева, то
.
Если в условной схеме ячейки 1-й электрод записан слева, то
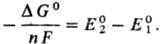

Из ур-ния следует, что
С. п., в свою очередь, м.б. использованы для расчета DG0
и константы равновесия К р-ции (ln К = — DG°/RT).
Значения E0, рассчитанные на основе значений DG0,
представлены в таблице; они далеко не всегда м. б. реализованы в электрохим.
цепях из-за того, что предполагаемое равновесие электродной р-ции в действительности
может не устанавливаться (это характерно для щелочных, щел.-зем. металлов и
большинства орг. в-в в водных р-рах).
В неводных р-рителях С.
п. также определяют по отношению к потенциалу водородного электрода для каждого
отдельного р-рителя. Ведется поиск стандартного электрода, потенциал к-рого
можно было бы считать практически не зависящим от природы р-рителя, что позволило
бы создать единую шкалу электродных потенциалов. В качестве таких электродов
предложены системы: рубидий/ион рубидия, ферроцен/ферроциний-катион и бис(дифенил)хром(I)/
/бис(дифенил)хром(0), потенциалы к-рых из-за большого размера ионов и соотв.
малой их сольватации незначительно (по сравнению с потенциалом водородного электрода)
зависят от природы р-рителя. Последние два электрода рекомендованы в 1984 ИЮПАК
в качестве электродов сравнения в неводных орг. средах.
Выбор электрода сравнения
и стандартного состояния исследуемого электрода в системах с расплавами и твердым
электролитом в большой мере определяется природой как исследуемого электродного
процесса, так и ионного проводника. В широко используемых в качестве электролитов
расплавах хлоридов металлов С. п. берется в хлорной шкале, т. е. в качестве
стандартного пользуются хлорным электродом в расплавленном хлориде (графит,
Сl2 [1,01 · 105 Па], MC1z [расплав]),
где М-металл (на практике обычно берут смесь хлоридов металла). Активность
катионов Мz+ в индивидуальном расплаве принимается
равной 1. В ряде высокотемпературных гальванич. элементов с твердым электролитом
в качестве электрода сравнения применяют оксидные электроды, в частности вюститовый
(Pt; Fe, FeO).
Лит.: Электрохимия
металлов в неводных растворах, пер. с англ., М., 1974; Методы измерения в электрохимии,
т. 1, пер. с англ., М., 1977; Шаталов А. Я., Введение в электрохимическую термодинамику,
М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Standard Potentials
in aqueous solution, ed. by A.J. Bard, N.Y.-Basel, 1985. Б.И. Подловченко.


