СТАНДАРТНОЕ СОСТОЯНИЕ
в химической термодинамике, состояние системы, выбираемое как состояние отсчета
при оценке термодинамич. величин. Необходимость выбора С. с. обусловлена тем,
что в рамках хим. термодинамики не м.б. рассчитаны абс. значения энергий Гиббса,
хим. потенциалов, энтальпий и др. термодинамич. величин для данного в-ва; возможен
расчет лишь относит. значений этих величин в данном состоянии в сравнении с
их значением в С. с.
С. с. выбирают из соображений
удобства расчетов; оно может меняться при переходе от одной задачи к другой.
Значения термодинамич. величин в С. с. называют стандартными и обозначают обычно
нулем в верх. индексе, напр. G0, H0, m0-соотв.
стандартные энергия Гиббса, энтальпия, хим. потенциал в-ва. Для хим. р-ции DG0,
DH0, DS0 равны изменениям соотв.
G0, H0 и S0
реагирующей системы в процессе перехода от исходных в-в в С. с. к продуктам
р-ции в С. с.
С. с. характеризуется стандартными
условиями: давлением p0, т-рой Т0, составом
(молярная доля x0). Комиссия ИЮПАК по термодинамике определила
(1975) в качестве основного
С. с. для всех газообразных в-в чистое в-во (х0 = 1)
в состоянии идеального газа с давлением р0 = 1 атм
(1,01 · 105 Па) при любой фиксир. т-ре. Для твердых и жидких в-в
основное С.с.-это состояние чистого (х0 = 1) в-ва,
находящегося под внеш. давлением р0 = 1 атм. В определение
С. с. ИЮПАК Т0 не входит, хотя часто говорят о стандартной
т-ре, равной 298,15 К.
Мн. газы при давлении 1
атм не могут рассматриваться как идеальный газ. С. с. в этих случаях не реальное,
а некое гипотетич. состояние. Подобный искусств. выбор С. с. объясняется простотой
расчетов термодинамич. ф-ций для идеального газа.
Для процесса образования
хим. соединения из простых в-в в термодинамич. справочниках приводятся стандартные
энергии Гиббса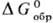 ,
энтальпии
,
энтальпии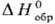 , энтропии
, энтропии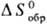
Для определения этих величин
выбирают нек-рые простые в-ва, для к-рых, по определению, выполняются условия:
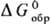 = 0,
= 0, 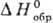 =0,
=0,
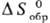 = 0. В качестве
С. с. для простых
в-в принимают устойчивое фазовое и хим. состояние элемента при данной т-ре.
Это состояние не всегда совпадает с естественным; так, С. с. простого в-ва фтора
при всех т-рах-чистый идеальный газ при 1 атм, состоящий из молекул F2;
при этом не учитывается диссоциация F2 на атомы. С. с. может быть
разным в разл. температурных интервалах. Для Na, напр., в интервале от 0 до
Тпл (370,86 К) С. с. простого в-ва-чистый металлич.
Na при 1 атм; в интервале от Тпл до Tкип
(1156,15 К)-чистый жидкий Na при 1 атм; выше 1156,15 К-идеальный газ при 1 атм,
состоящий исключительно из атомов Na. Т. обр., стандартная энтальпия образования
твердого NaF ниже 370,86 К соответствует изменению энтальпии в р-ции Na (тв)
+ 1/2F2 = = NaF (тв), а в
интервале 370,86-1156,15 К соответствует изменению энтальпии в р-ции Na (жидк)
+ 1/2 F2 = NaF(TB).
= 0. В качестве
С. с. для простых
в-в принимают устойчивое фазовое и хим. состояние элемента при данной т-ре.
Это состояние не всегда совпадает с естественным; так, С. с. простого в-ва фтора
при всех т-рах-чистый идеальный газ при 1 атм, состоящий из молекул F2;
при этом не учитывается диссоциация F2 на атомы. С. с. может быть
разным в разл. температурных интервалах. Для Na, напр., в интервале от 0 до
Тпл (370,86 К) С. с. простого в-ва-чистый металлич.
Na при 1 атм; в интервале от Тпл до Tкип
(1156,15 К)-чистый жидкий Na при 1 атм; выше 1156,15 К-идеальный газ при 1 атм,
состоящий исключительно из атомов Na. Т. обр., стандартная энтальпия образования
твердого NaF ниже 370,86 К соответствует изменению энтальпии в р-ции Na (тв)
+ 1/2F2 = = NaF (тв), а в
интервале 370,86-1156,15 К соответствует изменению энтальпии в р-ции Na (жидк)
+ 1/2 F2 = NaF(TB).
С. с. иона в водном р-ре
вводится для возможности пересчета экспериментально определяемых энтальпий растворения
DaqН0 (Н2О) в энтальпии
образования хим. соединения. Так, если известна стандартная энтальпия растворения
в воде КСl, а DН0обр [К+, р-р]
и 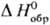 [Сl-,
р-р]-соотв. энтальпии образования ионов К+ и Сl в С. с. в водном
р-ре, то стандартная энтальпия образования КСl м. б. рассчитана по ур-нию:
[Сl-,
р-р]-соотв. энтальпии образования ионов К+ и Сl в С. с. в водном
р-ре, то стандартная энтальпия образования КСl м. б. рассчитана по ур-нию: 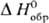 [КСl,
тв] = = - DaqH0(Н20) +
[КСl,
тв] = = - DaqH0(Н20) +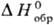 [К+,
р-р] +
[К+,
р-р] +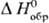 [Сl-,
р-р].
[Сl-,
р-р].
В качестве С. с. иона в
водном р-ре, согласно рекомендациям ИЮПАК, принимают состояние данного иона
в гипотетич. одномоляльном водном р-ре, в к-ром для рассматриваемого иона энтальпия
равна его энтальпии в бесконечно разб. р-ре. Кроме того, принимают, что энтальпия
образования иона Н+ в С.с., т.е. 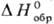 [Н+,
р-р, Н2О] равна нулю. В результате появляется возможность получения
относительных стандартных энтальпий образования др. ионов в р-ре на основе наиб.
надежных (ключевых) значений энтальпий образования хим. соединений. В свою очередь,
полученные значения энтальпий образования ионов в р-ре служат для определения
неизвестных энтальпий образования хим. соед. в тех случаях, когда стандартные
энтальпии растворения измерены.
[Н+,
р-р, Н2О] равна нулю. В результате появляется возможность получения
относительных стандартных энтальпий образования др. ионов в р-ре на основе наиб.
надежных (ключевых) значений энтальпий образования хим. соединений. В свою очередь,
полученные значения энтальпий образования ионов в р-ре служат для определения
неизвестных энтальпий образования хим. соед. в тех случаях, когда стандартные
энтальпии растворения измерены.
С. с. компонентов двух-
и многокомпонентных систем вводится как состояние отсчета при расчетах термодинамич.
активностей, энергий Гиббса, энтальпий, энтропии смешения (последние три величины
в С. с. равны нулю). Возможен т. наз. симметричный выбор С. с., при к-ром в
качестве С. с. компонента используется его основное С. с., определенное согласно
ИЮПАК. Если многокомпонентная система является жидкой, то и в качестве С. с.
компонентов берется их жидкое состояние. Альтернативой служит антисимметричный
выбор С. с., когда для р-рителя сохраняется С. с., выбранное согласно рекомендациям
ИЮПАК, а для растворенного в-ва А в качестве С. с. выбирается его состояние
в р-ре единичной концентрации, обладающим св-вами бесконечно разб. р-ра. Выбор
С. с. в этом случае связан с определенной концентрац. шкалой (молярная доля,
молярность, моляльность). Антисимметричный выбор С. с. удобен в тех случаях,
когда растворенное в-во не существует в данной фазе
в чистом виде (напр., НС1 не существует в виде жидкости при комнатной т-ре).
Понятие С. с. введено Г.
Льюисом в нач. 20 в.
Лит.: Льюис Дж.,
Рендалл М., Химическая термодинамика, пер. с англ., М., 1936; Белоусов В. П.,
Панов М. Ю., Термодинамика водных растворов неэлектролитов, Л., 1983: Воронин
Г.Ф., Основы термодинамики, М., 1987, с. 91, 98, 100. М.В. Коробов.


