СИЛИЦИДЫ, соед.
Si с менее электроотрицат. элементами, гл. обр. металлами. Известны для s-металлов
(кроме Be), большинства d-элементов (кроме Ag, Au, Zn, Cd, Hg) и всех
f-элементов; p-металлы С. не образуют. Неметаллич. p-эле-менты
в большинстве образуют соед. с Si, но их правильнее рассматривать как карбид,
борид, арсениды, селениды Si и т.п.
С.-кристаллич. в-ва с металлич.
блеском, б.ч. серебристо-белого или серого цвета; в их структуре имеются связи
М—Si, Si—Si и М—М. По типу хим. связи С. можно разделить на ионно-ковалентные
(С. щелочных и щел.-зем. металлов, а также Mg) и металлоподобные (С. переходных
металлов). Для первой группы характерно сочетание ионной связи между атомами
металла и Si с ковалентной связью между атомами Si. Металлоподобные С. характеризуются
сочетанием металлич. связи между атомами металла с ковалентной связью между
атомами Si, а также значит. долей ковалентной связи между атомами металла и
Si, возрастающей с уменьшением донорной способности металлов.
У низших С. металлич. структура
б.ч. с изолир. одиночными атомами Si (при условии, что отношение радиусов rSi/rM 0,84-0,85).
У этих С. чаще других встречаются структуры типа b-W с плотнейшей кубич.
упаковкой и типа a-Fe (кубич. объемноцентрир. решетка). Соед. типа фаз
внедрения среди С. не наблюдается. С повышением содержания Si появляются структуры
с изолир. парами атомов Si, с цепями, слоями и пространств. каркасами из атомов
Si. Большинство С. имеют состав от M3Si до MSi2. Наиб.
распространены составы MSi2, M5Si3, M3Si,
M2Si3 и M2Si. Для них характерно большое число
разл. структурных типов.
Известно неск. С. меди, Li и нек-рых др. металлов, содержащих меньше Si. Миним.
содержание Si наблюдается у Cu8Si. У тяжелых щелочных металлов известны
С. с большим содержанием Si (макс. содержание у CsSi8). Многие С.,
в особенности С. переходных металлов,-фазы переменного состава.
0,84-0,85).
У этих С. чаще других встречаются структуры типа b-W с плотнейшей кубич.
упаковкой и типа a-Fe (кубич. объемноцентрир. решетка). Соед. типа фаз
внедрения среди С. не наблюдается. С повышением содержания Si появляются структуры
с изолир. парами атомов Si, с цепями, слоями и пространств. каркасами из атомов
Si. Большинство С. имеют состав от M3Si до MSi2. Наиб.
распространены составы MSi2, M5Si3, M3Si,
M2Si3 и M2Si. Для них характерно большое число
разл. структурных типов.
Известно неск. С. меди, Li и нек-рых др. металлов, содержащих меньше Si. Миним.
содержание Si наблюдается у Cu8Si. У тяжелых щелочных металлов известны
С. с большим содержанием Si (макс. содержание у CsSi8). Многие С.,
в особенности С. переходных металлов,-фазы переменного состава.
С. s-металлов более
тугоплавки, чем соответствующие металлы, С. переходных металлов менее тугоплавки,
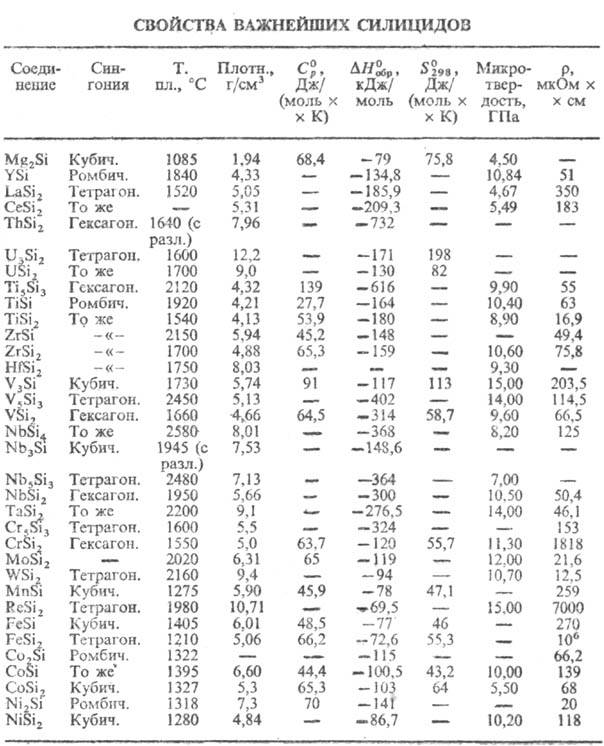
чем сами металлы. Металлоподобные С. большей частью обладают металлич. проводимостью
(см. табл.). Только нек-рые высшие С. этой группы-полупроводники. Часть металлоподобных
С. обладает сверхпроводниковыми св-вами, напр. V3Si с Ткрит
17 К. С. щелочных и щел.-зем. металлов-б. ч. полупроводники. С. s- и
d-элементов либо слабо парамагнитны, либо диамагнитны. С. V3Si,
Cr3Si, Mo3Si-антиферромагнетики, С. РЗЭ-либо ферро-, либо
антиферромагнетики.
Щелочные металлы, кроме
Li, образуют моносилициды MSi, в структуре к-рых атомы кремния составляют изолир.
тетраэдры Si4. При нагр. они переходят в полисилициды MSi6
и MSi8. Литии образует ряд С. с большим содержанием металла (Li22
Si5, Li2 Si и др.), в к-рых наряду с группировками атомов
Si существуют ковалентно-связанные группировки из атомов Li. С. щелочных металлов
легко окисляются, иногда со взрывом, под действием воды разлагаются с образованием
силанов.
Магний образует один С.
Mg2Si со структурой типа флюорита; устойчив к действию воды и р-ров
щелочей, энергично реагирует с к-тами; полупроводник с шириной запрещенной зоны
0,78 эВ. У др. щел.-зем. металлов известно по три-четыре С.-MSi, MSi2
и низшие С. разного состава. Эти С. устойчивы в сухом воздухе, но очень чувствительны
к влаге, бурно, иногда со взрывом, реагируют с к-тами и р-рами щелочей.
РЗЭ образуют большое число
С. Помимо указанных выше типов чаще др. встречаются M3Si2,
M5Si4, MSi и M3Si5. Меньше всего
С. у Еu (только EuSi и EuSi2); больше всего у Се (шесть). Т-ры плавления
С. РЗЭ мало зависят от содержания Si. С. РЗЭ устойчивы к окислению (в среде
О2 до ~ 500 °С). При длит. обработке водой разлагаются. При действии
минер. к-т также разлагаются с выделением сила-нов и Н2.
С. актиноидов менее устойчивы
к окислению, чем С. РЗЭ. С. тория разрушаются при длит. нахождении на воздухе,
С. урана устойчивы к О2 при нагр. только до 200 °С. В то же время
к воде и минер. к-там стойкость С. актиноидов выше.
Среди d-металлов
макс. число С. (6-7) известно для элементов IV гр., а также Мn и Сu. При
переходе к более тяжелым элементам в каждой группе отмечается тенденция к уменьшению
числа С. Наиб. высокие т-ры плавления характерны для С. со средним содержанием
SL С. переходных металлов, с водой не реагируют, не раств. или слабо раств.
в холодных и нагретых минер. к-тах, быстрее разлагаются р-рами щелочей. Очень
стойки, особенно высшие С., к окислению благодаря образованию на пов-сти пленок
силикатов или, в случае металлов, образующих летучие оксиды (Mo, Re, W)-пленки
SiO2.
Известно довольно много
двойных С., причем их компонентами м. б. металлы, для к-рых простые С. неизвестны,
напр. Au2EuSi2. Существуют С., содержащие др. неметаллы,
напр, фазы Новотного-Mo4Si3С, V5SiB2.
Наиб, распространенный
метод получения С-спекание или сплавление простых в-в (вариант-самораспространяющийся
высокотемпературный синтез). Иногда процесс проводят в р-ре (в расплаве Al,
Hg, Cu, Zn и др.), что позволяет резко снизить т-ру. После охлаждения С. отделяют
от металла-р-рителя хим. методом, Hg - возгонкой. С. получают также восстановлением
оксидов металлов элементарным Si или SiC, смесей оксидов металлов с SiO2-
углеродом или Al, Mg. Известен и электрохим. метод-электролиз расплава фторосиликатов
Na или К с добавкой оксида или соли металла, либо расплава смесей оксидов металла
и Si с CaF2, СаСl2 и СаСО3.
Реже используют методы
хим. осаждения из газовой фазы-восстановление смеси хлоридов (или бромидов)
Si и металла водородом или SiHal4 над порошком металла или нагретой
проволокой. Для синтеза С., а также выращивания небольших монокристаллов и пленок
используют хим. транспортные р-ции с С12, Вr2 или I2
в качестве транспортного агента. Объемные монокристаллы выращивают направленной
кристаллизацией и вытягиванием по Чохральскому.
С. используют как компоненты
керметов и жаростойких сплавов, т.к. они повышают стойкость к окислению. Из
MoSi2 изготовляют нагреватели электрич. печей, к-рые могут работать
в окислит. атмосфере до ~ 1700°С. Многие С. применяют как огнеупорные материалы,
в хим. машиностроении для изготовления облицовки реакторов, деталей насосов,
мешалок, теплообменников и др. С. железа и Мn -осн. компоненты соотв. ферросилиция,
силикомарганца и др. сплавов. С. кальция - основа сплава силикокальций. Образование
силицидных слоев на пов-сти металлов используют для повышения их жаростойкости.
Такими покрытиями защищают Mo, Nb, Та, W и их сплавы. Нек-рые С., в особенности
дисилициды Сr, Mn, Co, Re и др.,-полупроводниковые материалы, работающие при
высоких т-рах. С. РЗЭ, имеющих высокое поперечное сечение захвата тепловых нейтронов,
м. б. использованы как поглотители нейтронов, работающие при высоких т-рах.
Лит.: Гладышевский
Е. И., Кристаллохимия силицидов и германидов, М., 1971; Гельд П. В., Сидоренко
Ф.А., Силициды переходных металлов четвертого периода, М., 1971; Самсонов Г.
В., Дворина Л. А., Рудь Б. М., Силициды, М., 1979. П. И. Федоров.


