СЕРЫ ТРИОКСИД (серный
ангидрид) SO3, мол. м. 80,066; бесцв. жидкость; молекула имеет треугольную
конфигурацию с атомом S в центре, длина связи S—О 0,1418 нм, расстояние О—О
0,248 нм, угол OSO 120,0°, m = 0; т. кип. 44,7
°С; tкрит 218,3 °С, pкрит 8,2
МПа, dкрит 0,633 г/см3 (см. также табл. 1); диэлектрич.
проницаемость 3,11 (18°С); ниже 16,79 °С-прозрачные кристаллы, структура
к-рых построена из кольцевых молекул (SO3)3, кристаллич.
решетка ромбическая (a-SO3, а = 1,07 нм, b - 1,93 нм,
с = 5,30 нм, z = 12, пространств, группа Рпа2). В
присут. следов влаги (~ 1 моль Н2О на 106 молей SO3)
С. т. полимеризуется с образованием вначале b-SО3-бесцв.
шелковистые асбестоподобные кристаллы моноклинной сингонии, их структура состоит
из длинных зигзагообразных цепей —SO2 —О—SO2—, на концах
к-рых имеются группы ОН. При дальнейшей полимеризации b-форма переходит
в др. моноклинную модификацию g, в структуре к-рой указанные выше цепи
объединены в плоские сетки. Получена и d-форма (цепи объединены в объемные
структуры), ее т. пл. 95 °С (под давлением). g-SO3 при нормальном
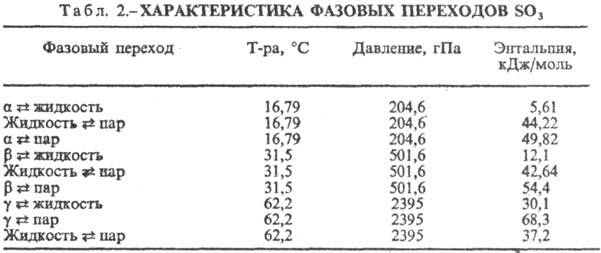
давлении не плавится, а возгоняется. Сведения о фазовых переходах С. т. даны
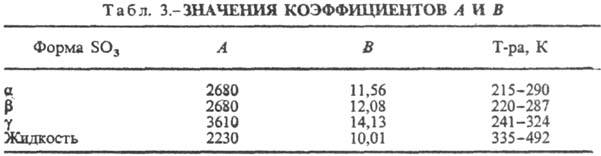
в табл. 2. Ур-ние температурной зависимости давления пара 1gр(гПа) =
— А/Т+ В, значения коэф. приведены в табл. 3. В парах в осн. присутствуют
молекулы SO3, в небольшом кол-ве-(SO3)3.
Переходы a :
b, b : g, g : d происходят медленно, b-форма
м. б. превращена в a только через паровую фазу (в отсутствие влаги) при
конденсации паров ниже 16,8°С. Термич. диссоциация SO3 :
SO2 + О2 начинается ок. 450 °С, при 1200 °С становится
практически полной. С. т. дымит на воздухе, с водой бурно реагирует с образованием
H2SO4 и выделением большого кол-ва тепла. Раств. в конц.
H2SO4, р-р наз. олеумом. Энергично реагирует с основаниями,
основными оксидами, солями, давая сульфаты. С НС1 образует хлорсульфоновую к-ту
HSO3Cl, с HF-HSO3F. С. т.-сильный окислитель, окисляет
S, P, углеводороды и др., восстанавливаясь до SO2. Реакц. способность
увеличивается в ряду d < g < b < a.
О пром. произ-ве С. т.
см. Серная кислота. В лаборатории С. т. получают прокаливанием Fe2(SO4)3
или Na2S2O7. Транспортируют жидкий С. т., его
полимеризацию предотвращают введением Р2О5, В2О3
и др. Перевозят С. т. в цистернах из малоуглеродистой стали. С. т.-промежут.

продукт в произ-ве серной
к-ты и олеума. Его используют также для получения HSO3C1, SeO3,
SO2C12 и др., как сульфирующий агент, для дегидратации
при- получении безводной азотной к-ты.
С. т. токсичен, поражает
слизистые оболочки и дыхат. пути, вызывает тяжелые ожоги кожи, ПДК в воздухе
рабочей зоны 1 мг/м3. И. Н. Один.


