СЕЛЕНА ОКСИДЫ. Диоксид
SеО2-бесцв. кристаллы тетрагон.
сингонии (а = 0,8353 нм, с = 0,5051 нм, z = 8, пространств,
группа Р42/mbс); пары желтовато-зеленые с запахом гнилой
редьки; т.пл. 389 °С, т. возг. 337 °С; плотн. 3,954 г/см3;
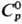 58,3 Дж/(моль·К);
58,3 Дж/(моль·К);
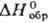 -225 кДж/моль,
-225 кДж/моль,
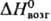 91 кДж/моль;
91 кДж/моль; 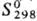 56,9
Дж/(моль · К); ур-ние температурной
зависимости давления пара: lgp (мм рт. ст.) = = 12,522-5807/T
(423-662 К); гигроскопичен, легко раств. в воде с образованием H2SeO3,
этаноле (6,25% по массе при 15°С), в уксусной и серной к-тах, мало раств.
в бензоле, не раств. в ацетоне, с безводным НС1 образует SeO2·4HCl;
получают сжиганием Se на воздухе или в О2 (в присут. NO2);
промежут. продукт при получении Se высокой чистоты. В природе-минерал доунеит
(селенолит).
56,9
Дж/(моль · К); ур-ние температурной
зависимости давления пара: lgp (мм рт. ст.) = = 12,522-5807/T
(423-662 К); гигроскопичен, легко раств. в воде с образованием H2SeO3,
этаноле (6,25% по массе при 15°С), в уксусной и серной к-тах, мало раств.
в бензоле, не раств. в ацетоне, с безводным НС1 образует SeO2·4HCl;
получают сжиганием Se на воздухе или в О2 (в присут. NO2);
промежут. продукт при получении Se высокой чистоты. В природе-минерал доунеит
(селенолит).
Селенистая к-та Н2SеО3-бесцв.
кристаллы ромбич. сингонии (а = 0,915 нм, Ъ = 0,600 нм, с —
0,505 нм, z = 4, пространств. группа P21212);
плотн. 3,004 г/см3;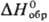 — 525 кДж/моль (при
быстром охлаждении р-ра кристаллизуется триклинная модификация); гигроскопична;
хорошо раств. в воде (62,5% по массе при 20 °С, 77,5% при 40 °С, 79,3%
при 60 °С); при 72 °С разлагается по перитектич. р-ции на SeO2
и насыщ. р-р; к-та средней силы K1 3,5·10, К2
5·10-8; при действии H2S, SO2, HI
и т.п. восстанавливается до элементарного Se; в кислых р-рах окисляется Н2О2
и КМnО4 до H2SeO4.
— 525 кДж/моль (при
быстром охлаждении р-ра кристаллизуется триклинная модификация); гигроскопична;
хорошо раств. в воде (62,5% по массе при 20 °С, 77,5% при 40 °С, 79,3%
при 60 °С); при 72 °С разлагается по перитектич. р-ции на SeO2
и насыщ. р-р; к-та средней силы K1 3,5·10, К2
5·10-8; при действии H2S, SO2, HI
и т.п. восстанавливается до элементарного Se; в кислых р-рах окисляется Н2О2
и КМnО4 до H2SeO4.
Соли селенистой к-ты-селенаты(IV),
или селениты,-образуются при взаимод. SeO2 или H2SeO3
с оксидами, гидроксидами или карбонатами металлов. Нерастворимые селениты можно
получить при действии р-ра Na2SeO3 или K2SeO3
на р-ры солей соответствующих металлов. Селениты щелочных металлов хорошо раств.
в воде, все остальные-практически нерастворимы. Мн. селениты щел.-зем. и тяжелых
металлов образуют кристаллогидраты. При нагр. на воздухе селениты щелочных и
щел.-зем. металлов окисляются до селенатов(VI), при нагр. в инертной атмосфере
разлагаются на оксиды. Нек-рые селениты встречаются в виде минералов, напр.
халькоменит CuSeO3 · Н2О.
Селенит натрия Na2SeO3-бесцв.
кристаллы моноклинной сингонии; т.пл. 711°С; плотн. 3,07 г/см3;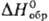 —960,6 кДж/моль; при медленном нагревании в инертной атмосфере начинает диссоциировать
выше 600 °С, при нагр. на воздухе выше 690 °С окисляется до селената(VI);
гигроскопичен, хорошо раств. в воде (46,2% по массе при 20 °С, 47,8% при
60 °С); из водных р-ров при т-ре от —8,7 до 35,9 °С кристаллизуется
пентагидрат (плотн. 2,7 г/см3), ниже —
8,7°С-октагидрат, выше 35,9 °С-безводная соль. Тригидроселенит натрия
NaН3(SеО3)2-бесцв. кристаллы моноклинной сингонии
(а = 1,177 нм, b = 0,484 нм, с = 0,580 нм, b = 118,5°,
z = 2); т. пл. 110,2 °С;
—960,6 кДж/моль; при медленном нагревании в инертной атмосфере начинает диссоциировать
выше 600 °С, при нагр. на воздухе выше 690 °С окисляется до селената(VI);
гигроскопичен, хорошо раств. в воде (46,2% по массе при 20 °С, 47,8% при
60 °С); из водных р-ров при т-ре от —8,7 до 35,9 °С кристаллизуется
пентагидрат (плотн. 2,7 г/см3), ниже —
8,7°С-октагидрат, выше 35,9 °С-безводная соль. Тригидроселенит натрия
NaН3(SеО3)2-бесцв. кристаллы моноклинной сингонии
(а = 1,177 нм, b = 0,484 нм, с = 0,580 нм, b = 118,5°,
z = 2); т. пл. 110,2 °С;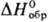 —1307 кДж/моль; раств.
в воде (52% при 20 °С, 73% при 60 °С); при нагр. до 320 °С превращ.
в диселенит (пиро-селенит) Na2Se2O5; получают
взаимод. р-ров Na2CO3 и H2SeO3 с
послед. упариванием; сегнетоэлектрик.
—1307 кДж/моль; раств.
в воде (52% при 20 °С, 73% при 60 °С); при нагр. до 320 °С превращ.
в диселенит (пиро-селенит) Na2Se2O5; получают
взаимод. р-ров Na2CO3 и H2SeO3 с
послед. упариванием; сегнетоэлектрик.
Триоксид SеО3-бесцв.
кристаллы тетрагон. сингонии (а = 0,9636 нм, с = 0,528 нм, z
= 8, пространств. группа 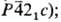 т.пл. 121 °С; плотн. 3,6 г/см3; при 240°С разлагается до
Sе2О5; ур-ния температурной зависимости давления пара:
lgp (мм рт.ст.) = 10,294 - 3865/T(252-392 К), lgp (мм рт.
ст.) = 7,201-2562/T(для жидкого); пары-смесь SeO3 и Se4O12;
т.пл. 121 °С; плотн. 3,6 г/см3; при 240°С разлагается до
Sе2О5; ур-ния температурной зависимости давления пара:
lgp (мм рт.ст.) = 10,294 - 3865/T(252-392 К), lgp (мм рт.
ст.) = 7,201-2562/T(для жидкого); пары-смесь SeO3 и Se4O12;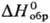 -173
кДж/моль,7,7
-173
кДж/моль,7,7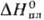 кДж/моль,
кДж/моль, 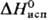 30,5 кДж/моль;
30,5 кДж/моль; 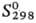 84,1 Дж/(моль·К); гигроскопичен,
с водой реагирует с большим тепловыделением и образованием Н2SеО4;
сильный окислитель; бурно реагирует с орг. в-вами; получают при нагр. смеси
H2SeO4 с Р2О5 или K2SeO4
с SO3 с послед. отгонкой.
84,1 Дж/(моль·К); гигроскопичен,
с водой реагирует с большим тепловыделением и образованием Н2SеО4;
сильный окислитель; бурно реагирует с орг. в-вами; получают при нагр. смеси
H2SeO4 с Р2О5 или K2SeO4
с SO3 с послед. отгонкой.
Селеновая к-та H2SeO4-кристаллы
ромбич. сингонии (а — 0,855 нм, b = 0,817 нм, с - 0,461
нм, z = 4, пространств. группа Р21212);
плотн. 2,95 г/см3; т.пл. 62,4°С, выше 260°С разлагается;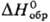 —
532,6 кДж/моль,14,4
—
532,6 кДж/моль,14,4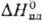 кДж/моль.
кДж/моль.
Моногидрат H2SeO4
· Н2О имеет т. пл. 25,4 °С, т. кип. 205 °С; из р-ров при
низких т-рах выделяются также гидраты с 2, 4 и 6 молекулами воды. H2SeO4
очень гигроскопична, сильная к-та, подобная H2SO4; окислитель;
конц. к-та при нагр. растворяет Pd и Аu, легко обугливает орг. в-ва; разб. к-та
восстанавливается весьма медленно.
Соли Н2SеО4-селенаты(VI)-м.б.
получены нейтрализацией к-ты оксидами, гидроксидами или карбонатами металлов
или окислением селенитов. По св-вам и по структуре аналогичны сульфатам, образуют
кристаллогидраты. Многие хорошо раств. в воде, часто лучше сульфатов. Мало растворимы
селенаты щел.-зем. металлов, Pb, Ag, Та. При термич. разложении селенатов часто
в качестве про-межут. продуктов образуются селениты.
Селенат натрия Na2SeO4
- кристаллы ромбич. сингонии; т.пл. 730 °С, при 535 °С претерпевает
полиморфное прев-ращ.; плотн. 3,21 г/см3; 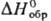 —1067 кДж/моль; раств. в
воде (11,6% при 0°С, 42,2% при 75 °С); ниже 32 °С кристаллизуется
из водных р-ров в виде декагидрата Na2SeO4·10H2O
(плота. 1,61 г/см3).
—1067 кДж/моль; раств. в
воде (11,6% при 0°С, 42,2% при 75 °С); ниже 32 °С кристаллизуется
из водных р-ров в виде декагидрата Na2SeO4·10H2O
(плота. 1,61 г/см3).
Оксид Se(V) (диселенпентаоксид)
Se2O5-кристаллы моноклинной сингонии (а — 0,4585
нм, b = 0,6972 нм, с = 1,389 нм, b = 91,98°, z — 4,
пространств. группа Р21/с); плотн. 3,58 г/см3;
т.пл. 224°С; 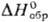 -413,4 кДж/моль;
-413,4 кДж/моль;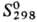 159 Дж/(моль·К); при
260 °С разлагается до SeO2; раств. в воде с образованием смеси
H2SeO3 и H2SeO4. Моноксид SeO обнаружен
только в газовой фазе.
159 Дж/(моль·К); при
260 °С разлагается до SeO2; раств. в воде с образованием смеси
H2SeO3 и H2SeO4. Моноксид SeO обнаружен
только в газовой фазе.
С. о. и их производные-промежут.
продукты в технологии Se. Селениты и селенаты применяют для обесцвечивания и
окрашивания стекла, в произ-ве эмалей и глазурей, при получении люминофоров
и пигментов, инсектицидов.
С. о. и их производные
вызывают ожоги кожи, поражают слизистые оболочки и дыхат. пути; ПДК 0,1 мг/м3.
П. И. Федоров.


