РТУТИ ОКСИДЫ. Гемиоксид
Hg2O-черные кристаллы; плотн. 9,8 г/см3; разлагается на
HgO и Hg при нагр. и под действием света; 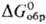 — 54,4 кДж/моль,
— 54,4 кДж/моль,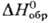 — 91,3 кДж/моль; получают
действием паров воды на ртуть при т-ре до 300 °С. При добавлении щелочей
к р-ру солей Hg(I) протекает ряд последоват. р-ций, в к-рых образующиеся гидроксид
и оксид Hg(I)-промежут. продукты с коротким временем жизни:
— 91,3 кДж/моль; получают
действием паров воды на ртуть при т-ре до 300 °С. При добавлении щелочей
к р-ру солей Hg(I) протекает ряд последоват. р-ций, в к-рых образующиеся гидроксид
и оксид Hg(I)-промежут. продукты с коротким временем жизни: 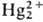 +
2ОН-
+
2ОН- 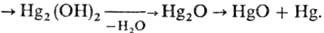 Константа равновесия гидролиза
Константа равновесия гидролиза 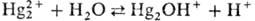 равна 1·10-5. Hg2O плохо раств. в воде (произведение р-римости
1,6·10-23).
равна 1·10-5. Hg2O плохо раств. в воде (произведение р-римости
1,6·10-23).
Оксид HgO образует две
кристаллич. модификации-желтую и красную, отличающиеся размерами кристаллов
(желтая-до 4 мкм, красная - выше 8 мкм). Для желтого HgO: плотн. 11,03 г/см3;
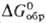 —58,517 кДж/моль,
—58,517 кДж/моль,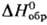 - 90,458 кДж/моль;
- 90,458 кДж/моль;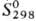 71,287
ДжДмоль · К). Для красного HgO: плотн. 11,14 г/см3;
71,287
ДжДмоль · К). Для красного HgO: плотн. 11,14 г/см3; 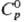 44,057 ДжДмоль·К);
44,057 ДжДмоль·К);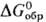 -58,639 кДж/моль,
-58,639 кДж/моль,
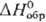 -90,876 кДж/моль;
-90,876 кДж/моль;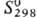 70,29 ДжДмоль *К).
HgO-слабое основание. Желтая форма химически более активна, разлагается при
332 °С. -Красная форма разлагается ок. 500 °С, при нагр. чернеет, но
приобретает прежний цвет при охлаждении. Желтая модификация при нагр. краснеет.
Порошки HgO в ИК спектре имеют полосы поглощения с максимумами при 491 и 595см-1;
фосфоресцирует в спектральной области 2,0-4,5 эВ; магн. восприимчивость —(0,216-0,221)·10-9;
e 9,4-12,6 (298 К).
70,29 ДжДмоль *К).
HgO-слабое основание. Желтая форма химически более активна, разлагается при
332 °С. -Красная форма разлагается ок. 500 °С, при нагр. чернеет, но
приобретает прежний цвет при охлаждении. Желтая модификация при нагр. краснеет.
Порошки HgO в ИК спектре имеют полосы поглощения с максимумами при 491 и 595см-1;
фосфоресцирует в спектральной области 2,0-4,5 эВ; магн. восприимчивость —(0,216-0,221)·10-9;
e 9,4-12,6 (298 К).
Р-римость HgO в воде (моль/л):
2,6·10-4-желтый и 2,4·10-4-красный при 25°С; 3,47·10-4
при 35°С-желтый. HgO не раств. в этаноле и диэтиловом эфире, раств. в конц.
р-рах щелочей с образованием гидроксокомплексов. Желтый HgO реагирует с NH3,
давая желтое малорастворимое в воде основание Миллона: 2HgO + NH3
+ + H2O:[Hg2N]+OH-·2H2O,
к-рое реагирует с к-тами с образованием солей [Hg2N] X·Н2О,
где X=
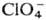 Сl-, Вr-, I- и др.
Сl-, Вr-, I- и др.
Красный HgO получают сухим
или мокрым способом. При сухом способе Hg окисляют О2 или О3
при 300-400 °С или осторожно нагревают Hg2(NO3)2
либо Hg(NO3)2 до 350-400 °С. При мокром способе из
горячих р-ров солей Hg(II) осаждают HgO гидроксидами щелочных или щел.-зем.
металлов; образующийся при введении щелочей Hg(OH)2 тотчас распадается
на HgO и Н2О. Получают HgO также анодным растворением Hg в р-рах
щелочей. В зависимости от т-ры электролиза и состава электролита образуется
красный или желтый HgO. Стандартный электродный потенциал E0
полуреакций:
HgO (красный) + Н2О
+ 2е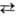 Hg + 2ОН-
(E0 = +0,0981 В)
Hg + 2ОН-
(E0 = +0,0981 В)
HgO + 2Н+ +
2е : Hg + Н2О (+0,926 В) Hg(OH)2 + 2Н+
+ 2е : Hg + 2Н2О (+1,034 В)
2HgO + 4Н+ +
2е : 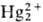 +
2Н2О (+1,065 В)
+
2Н2О (+1,065 В)
2Hg (ОН)2 +
4Н+ + 2е :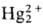 +
4Н2О (+1,279 В)
+
4Н2О (+1,279 В)
Желтый HgO получают действием
щелочей на р-ры солей Hg(II) при комнатной т-ре; Hg(OH)2 начинает
осаждаться при рН ~2, полное осаждение происходит при рН 5-12. Желтый и красный
HgO-окислители в препаративной химии, пигменты красок для морских судов; желтый
-компонент кожных мазей, красный-деполяризатор в ртутно-цинковых и ртутно-индиевых
элементах.
Желтый HgO встречается
в природе в виде минерала монтроидита (решетка орторомбическая, а = 0,6608
нм, Ъ = 0,5518 нм, с = 0,3519 нм, z = 4, пространств. группа
Рпта).
Пероксид HgO2-кристаллы;
неустойчив, взрывается при нагр. и ударе; получают взаимод. желтого HgO с 30%-ным
р-ром Н2О2 при — 15°С или при добавлении к спиртовому
р-ру HgCl2 р-ра Н2О2 и К2СО3.
При сухом способе синтеза HgO сплавляют с пероксидом щелочного металла и получают
бесцв. соед. M2HgO2, к-рое разлагается водой на HgO2
и МОН (M2HgO2 содержит структурные фрагменты [О—Hg—О]2-).
Р.O. токсичны, ПДК HgO
(в пересчете на Hg) в воздухе рабочей зоны 0,2 мг/м3, в атм. воздухе
0,0003 мг/м3.
Л. Ф. Козин.


