РИБОНУКЛЕОЗИД-ДИФОСФАТ-РЕДУКТАЗЫ
(рибо-нуклеотидредуктазы), ферменты класса оксидоредуктаз, катализирующие восстановление
рибонуклеозиддифосфатов в 2-дезоксирибонуклеозиддифосфаты:
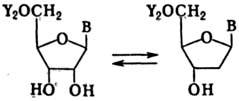
Y-остаток фосфорной
к-ты, В-остаток пуринового или пиримидинового основания Р.
способны катализировать превращения фосфоэфиров нуклеозидов всех четырех типов
(аденозина, гуанозина, уридина, цитидина); содержатся во всех живых организмах,
как в цитоплазме, так и в ядре. С участием Р. реализуется осн. путь биосинтеза
дезоксинуклеозидтрифосфатов-предшественников ДНК.
Наиб. изучены Р. из Escherichia
coli (E.coli), печени мыши, тимуса теленка, а также из ряда опухолевых клеток
мыши и человека. Эти Р. (мол. м. 240-300 тыс.) представляют собой тетрамеры
типа a2b2. У E.coli субъединицы a2
обозначают В1 (у др. млекопитающих-Ml), субъединицы b2-В2 (М2).
Мол. м. В1 составляет 160 тыс. (Ml-170 тыс.), В2-78 тыс. (М2-110 тыс.). Субъединица
В1(М1) содержит центр связывания субстрата и окисляемые в р-ции группы SH, субъединица
В2(М2)-кофактор (представляет собой комплекс двух ионов Fe3+ с неск.
группами SH). В состав кофактора входит также остаток тирозина, участвующий
в восстановлении субстрата в свободнорадикальной форме. Оптим. каталитич. активность
этих Р. проявляется при рН 7,5-8,0. Установлены первичные структуры фермента
из E.coli и печени мыши.
Регуляция Р. осуществляется
по аллостерич. механизму. Нуклеозидтрифосфаты и дезоксинуклеозидтрифосфаты могут,
в зависимости от условий, служить как активаторами, так и ингибиторами ферментов
из E.coli и клеток животных. Известен также ряд специфич. ингибиторов ферментов
(в т. ч. необратимого действия), гл. обр. производных гидрок-симочевины и нек-рых
аналогов нуклеотидов.
В бактериях видов Lactobacillus
и Euglena (напр., в L. leichmanii) превращение рибонуклеозидфосфатов в дезо-ксирибонуклеозидфосфаты
осуществляется с помощью ри-бонуклеозид-трифосфат-редуктаз, состоящих из одной
полипептидной цепи с мол. м. ок. 78 тыс. Субстраты этих ферментов - рибонуклеозидтрифосфаты,
кофермент - 5-дезо-ксиаденозилкобаламин (см. Витамин В12).
Измерение активности Р.
в организме используют для диагностики нек-рых злокачеств. опухолей.
Лит.: Thelander
L., Reichard P., "Ann. Rev. Biochem.", 1979, № 48, p. 133-58; Sjoeberg
B.M., Graeslund A., "Adv. Inorg. Biochem.", 1983, v. 5, p. 87-110;
Stubbe J.A., "J. Biol. Chem.", 1990, v. 265, № 10, p.,6329-32. C.H.
Кочетков.


