РАЙМЕРА-ТИМАНА РЕАКЦИЯ,
получение ароматич. о-гидроксиальдегидов формулированием фенолов при
нагр. с хлороформом и щелочью, напр.:
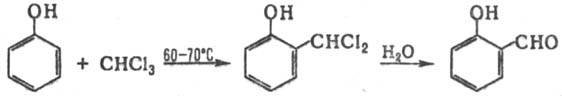
Р-цию обычно осуществляют
в этаноле или пиридине. Наряду с о-гидроксиальдегидом, как правило, образуется
незначит. кол-во пара-изомера, особенно в тех случаях, когда орто-положение
в исходном феноле занято. Вместо СНС13 можно использовать др. галоформы-СНВr3
и СНI3.
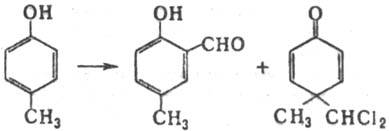
В Р.-Т.р. вступают алкил-,
алкокси- и галогенфенолы, причем легче всего реагируют соед., содержащие указанные
заместители в пара-положении к гидроксигруппе. Выходы о-гидроксиальдегидов
обычно меньше 50%. Наличие в ароматич. ядре электроноакцепторных заместителей
(SO3H, СООН, NO2 и др.) затрудняет р-цию, и выходы ожидаемых
продуктов обычно невелики. В случае о- и n-алкил(арил)-фенолов
наряду с о-гидроксиальдегидами могут образовываться гем-производцые
(аномальная Р.-Т. р.), напр.:
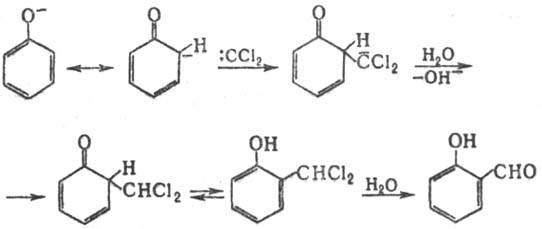
Механизм р-ции включает
образование из СННаl3 под действием щелочи дигалогенкарбена, к-рый
атакует фенолят-анион:
Формилирование фенолов
возможно также действием на них галоформа при УФ облучении (т. наз. фотохимическая
Р.-Т. р.). В этом случае р-ция осуществляется по радикальному механизму (генерируются
феноксильные радикалы и СННа12):
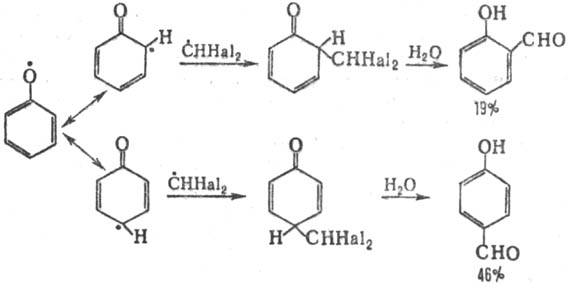
Аналогично происходит формилирование
М.М-диалкиланилинов.
В р-цию, подобную Р.-Т.р., вступают также гидрокси-производные ряда нафталина, хинолина, трополона, тиазо-ла и др., напр.
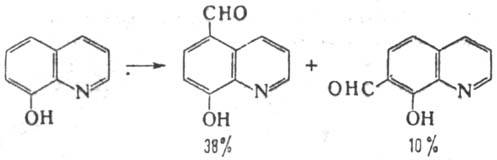
Изоэлектронные аналоги
фенолов (пиррол, индол и их производные) реагируют с галоформами по механизму
Р.-Т. р. с образованием соотв. альдегидов, и гем-замещен-ных производных,
напр.:
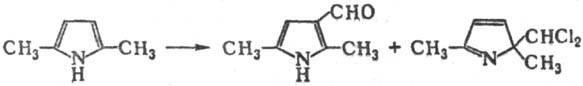
В нек-рых случаях в условиях
Р.-Т.р. наблюдалось расширение кольца вследствие внедрения дихлоркарбена (Ча-мичана-Деништедта
р-ция), напр.:
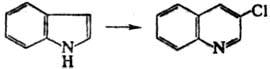
Р.-Т.р. находит практич.
применение, напр., в пром. синтезе салицилового альдегида. Р-ция открыта К.
Райме* ром и Ф. Тиманом в 1876.
Лит.: Трюс У.Э., в сб.: Органические реакции, пер. с англ., сб. 9, М., 1959, с. 45-81; Общая органическая химия, пер. с англ., т. 2. М., 1982, с. 711-12; Wynherg Н., "Cham. Rev.", 1960, v. 60, № 2, p. 169-84; Organic reactions, v. 28, N.Y., 1982, p. 1. Л.А. Хейфиц.


