ПУРИНОВЫЕ ОСНОВАНИЯ,
прир. производные пурина. Входят в качестве агликонов (неуглеводного компонента)
в нуклеиновые к-ты, нуклеозиды, нуклеотиды; фрагменты коферментов, витаминов
и др. Канонические П. о. нуклеиновых к-т-аденин (6-аминопурин, сокращенно А)
и гуанин (2-амино-6-пуринон, G). Разл. формы молекул П. о., к-рые существуют
при разных значениях рН, и таутомерные формы показаны на схеме:
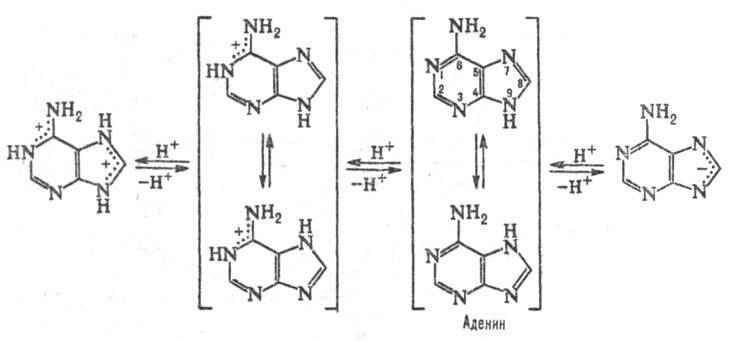
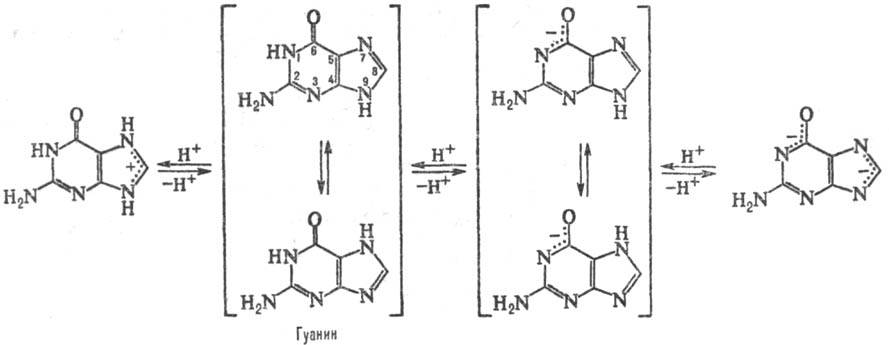
Кроме канонических П. о.
в состав нуклеиновых к-т входят т. наз. минорные П. о. (см. Минорные нуклеозиды),
гл. обр. метилированные по экзоциклич. аминогруппе и (или) по атомам N гетероцикла.
Эти основания образуются фермен-тативно в составе полинуклеотидов и играют важную
роль в регуляции репликации и транскрипции, в защите клеток от чужеродных ДНК
(см. Рестрикция и модификация ДНК)и системы трансляции от действия антибиотиков
и др.
Образование специфич. водородных
связей П. о. с пирими-диновыми основаниями в комплементарных участках
цепей нуклеиновых к-т (см. Комплементарность), как и межплоскостные
взаимод. между соседними основаниями в поли-нуклеотидной цепи, определяют формирование
вторичной и третичной структур нуклеиновых к-т. В комплементарных участках помимо
канонич. пар П. о. с пиримидиновыми основаниями (А-Т и G-С; Т и С-соотв. цитозин
и тимин) могут образовываться неканонич. пары (G-G, G-A, G-T и др.).
Последовательность пуриновых
и пиримидиновых оснований в полинуклеотидной цепи определяет генетич. информацию,
заключенную в ДНК, вирусных и матричных РНК.
Дезаминирование аденина
в составе поли-нуклеотида (превращение в гипоксантин) меняет информац. смысл
и приводит к точковой мутации. Дезаминирование гуанина (превращение его в ксантин)
в составе матричных полинуклеотидов приводит к блокированию репликации и транскрипции.
Метилирование П. о. по N-7 в составе матричных полинуклеотидов не сопровождается
изменением генетич. смысла основания.
П. о. представляют собой
высокоплавкие (т. пл. > 250 °С), бесцв. кристаллич. соед., плохо раств.
в горячей воде (особенно гуанин), не раств. в этаноле и диэтиловом эфире. Содержание
редких таутомерных форм (иминотаутоме-ры А и G по С-6 и С-2 соотв., енольного
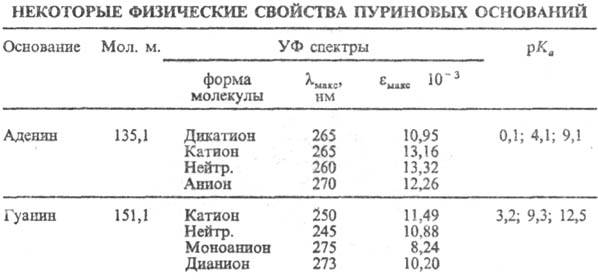
таутомера G по С-6) не превышает в норм. условиях 10-3%. Протонирование
и депрото-нирование П. о. сопровождается изменениями УФ спектров поглощения
(см. табл.) и реакц. способности.
Хорошо изучены р-ции ацилирования
и дез-аминирования экзоциклич. аминогрупп П. о. действием азотистой к-ты и замещение
аминогруппы аденина при действии гидроксил-аминов. Алкилирование П. о. идет
по атомам N циклов (реакц. способность уменьшается в ряду: N-9 > N-7 >
> N-3 > N-1), по экзоциклич. аминогруппам и по атому О-6 гуанина. Возможно
прямое га-логенирование по атому С-8. При действии орг надкислот на
аденин образуются N-оксиды по атомам N имида - зольного цикла. При действии
формальдегида образуются N-ме-тилольные соединения. Хлор- и бромацетальдегид
избирательно реагирует с аденином, образуя т. наз. этеноаденин в результате
взаимод. альдегидной группы с аминогруппой аденина и последующего N-1 алкилирования
с участием а-атома С реагента. Глиоксаль и кетоксаль избирательно реагируют
с гуанином, образуя третий гетероцикл в результате р-ций карбонильных групп
агента с экзоциклич. аминогруппой и атомом N-1. Скорости всех этих р-ций весьма
существенно зависят от локальных особенностей высшей структуры полинуклеотида,
что широко используют для изучения вторичной и третичной структур нуклеиновых
к-т. Канонические и минорные П. о. могут быть получены препаративно из нуклеиновых
к-т путем кислотного гидролиза и послед. разделения. Гуанин в больших кол-вах
получают из рыбьей чешуи.
Лит. см. при ст.
Муимидиновые основания. Э. И. Будовский.


